题目内容
11.下列通过试剂间两两反应不能鉴别的是( )| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
分析 将各组溶液两两混合,若现象各不相同,即可鉴别.A中MaOH溶液和AlCl3溶液、B中NaAlO2和HCl溶液、D中AgNO3溶液和氨水溶液滴加顺序不同,现象不同;但是NaHCO3溶液和HCl溶液反应只生成气体,现象相同,不能鉴别,以此解答.
解答 解:A.NaOH溶液和AlCl3溶液滴加顺序不同,现象不同:将NaOH溶液滴加到AlCl3 溶液中,先生成沉淀,当NaOH过量时,沉淀溶解,可鉴别,故A不选;
B.NaAlO2和HCl溶液滴加顺序不同,现象不同:将NaAlO2滴加到HCl溶液中先没有沉淀生成,当滴加到一定程度时有沉淀生成,但将HCl滴加到NaAlO2溶液中,开始就有沉淀生成,当完全反应后再滴加溶液,沉淀逐渐溶解,可鉴别,故B不选;
C.NaHCO3、HCl的反应与量无关,改变滴定顺序,现象相同,不能鉴别,故C选;
D.AgNO3溶液和氨水混合,硝酸银加入氨水中,氨水过量,生成银氨络离子,没有沉淀生成,如将氨水加入到硝酸银溶液中,开始生成沉淀,现象不同,可鉴别,故D不选.
故选C.
点评 本题考查物质的鉴别,题目难度中等,侧重与量有关的离子反应及物质检验现象的考查,注意在解答这类题时要注意利用物质化学特性来选择合适的物质进行区分,两两之间反应,可一一鉴别.

练习册系列答案
相关题目
1.根据键能数据(H-Cl 431kJ/mol,H-I 297kJ/mol),可得出的结论是( )
| A. | HI比HCl稳定 | |
| B. | HI比HCl熔、沸点高 | |
| C. | 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸 | |
| D. | 拆开等物质的量的HI和HCl,HI消耗的能量多 |
2.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| B. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 等物质的量浓度的 ①NH4Cl溶液②(NH4)2SO4溶液 ③NH4HSO4溶液④(NH4)2CO3溶液中NH4+浓度的大小关系是 ②>④>①>③ |
19.根据下列热化学方程式:
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1;
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1;
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
(1)C(s)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1;
(2)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1;
(3)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ•mol-1
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | △H=244.1 kJ•mol-1 | B. | △H=-488.3 kJ•mol-1 | ||
| C. | △H=-996.6 kJ•mol-1 | D. | △H=996.6 kJ•mol-1 |
6.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | HCHO、Al2O3均含有氧元素,属于氧化物 | |
| B. | H2SO4、HNO3均为强酸,属于强电解质 | |
| C. | 蓝宝石、明矾的主要成分都是含有铝元素的氧化物 | |
| D. | AlCl3、Na2O2都属于离子化合物 |
16.甲苯、四氯化碳、己烯、碘化钾溶液、亚硫酸钠溶液均为无色液体,只用一种试剂就可鉴别的是( )
| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
3.反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1 平衡常数为K1
Fe(s)+H2O (g)?FeO(s)+H2 (g)△H2 平衡常数为K2
在不同温度时K1、K2的值如表:
据此可知反应“CO2(g)+H2(g)?CO(g)+H2O(g)△H 平衡常数为K″的相关信息不正确的是( )
Fe(s)+H2O (g)?FeO(s)+H2 (g)△H2 平衡常数为K2
在不同温度时K1、K2的值如表:
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
| A. | △H=△H1-△H2 | |
| B. | K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 该反应进行时不断分离出H2O,可以提高CO2的转化率和反应速率 | |
| D. | 该反应正反应为吸热反应 |
20.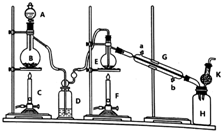 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
某同学设计的相关实验装置图如图:
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
 制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:
制备纯净的液态无水四氯化锡(SnCl4易挥发形成气体,极易发生水解)的反应为:Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,Sn也可与HCl反应生成SnCl2,已知:| 物质 | 摩尔质量/(g•mol-1) | 熔点/℃ | 沸点/℃ |
| Sn | 119 | 232 | 2260 |
| SnCl2 | 190 | 246.8 | 623 |
| SnCl4 | 261 | -30.2 | 114.1 |
| MnO2 | 87 | 535(分解) | - |
(l)A中浓盐酸与B中物质进行反应,化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)D中的试剂为浓硫酸,目的是除去H2O.
(3)G中冷却水的进水位置为b(填字母).
(4)为避免E中副反应的发生,对装置需要改进的措施是BD间增加盛饱和食盐水的洗气瓶.
(5)K中固体物质的作用为防止空气中水分进入.
(6)当要结束实验时,不能首先进行的操作是③.①关闭A的活塞 ②停止F的加热 ③停止G的通水.
(7)若将B中的固体换成Sn,并将除A和B以外的器皿去掉,反应可制备SnCl2.
(8)实验结束后,若得到的SnCl4为13.05g,至少消耗8.70g MnO2.为了避免尾气污染,需要改进的措施是在K后面加尾气吸收装置.
1.可以用AG来表示溶液的酸度.AG与pH的关系如图:则下列说法正确的是( )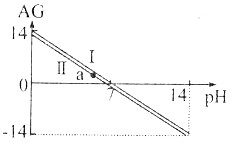

| A. | AG与pH的关系一定是AG=14-2pH | |
| B. | 直线Ⅰ和Ⅱ是因溶液的温度不同引起的,且T(Ⅰ)>T(Ⅱ) | |
| C. | AG=0时,溶液一定呈中性 | |
| D. | a点的溶液中可以有大量Na+、Cl-、Fe3+存在 |