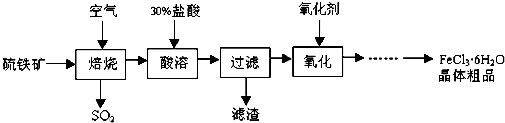
题目内容
14.将铜投入一定量的稀硝酸中,铜完全溶解后,测得反应后溶液中Cu2+和NO3-的物质的量之比为3:7,则参加反应的HNO3与反应前HNO3的物质的量之比是( )| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
分析 涉及反应为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,溶液中Cu2+与NO3-的物质的量之比为3:7,此时的硝酸根离子是剩余的硝酸根离子,结合方程式计算即可,以此解答该题.
解答 解:对于反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,反应后溶液中Cu2+与NO3-的物质的量之比为3:7,
设溶液中铜离子物质的量是3mol,则消耗硝酸的物质的量是8mol,生成的硝酸铜中硝酸根离子是6mol,所以剩余的硝酸根离子是1mol,反应之前的硝酸是9mol,则参加反应的HNO3与反应前HNO3的总的物质的量之比是8:9.
故选B.
点评 本题考查了硝酸的性质及有关氧化还原反应的计算,为高频考点,把握发生的化学反应为解答该题的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列有关非金属元素及其化合物说法正确的是( )
| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
19.两种金属混合物粉末15g,与足量的盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是( )
| A. | Mg、Fe | B. | Zn、Ag | C. | Fe、Zn | D. | Mg、Al |
3.将Na、Al、Al2O3三种物质的混合物加入水中,完全反应后,所得溶液中只含有NaAlO2一种溶质,则Na、Al、Al2O3的物质的量之比可能是( )
| A. | 1:1:2 | B. | 1:4:1 | C. | 4:4:1 | D. | 4:2:1 |

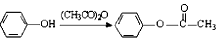
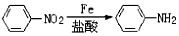
 .
.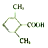 (或
(或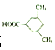 ).
).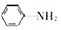 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,参照以上的合成路线,设计一条以A为原料合成化合物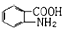 的合成路线
的合成路线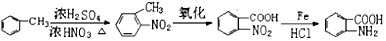 .
.