题目内容
5.下列有关非金属元素及其化合物说法正确的是( )| A. | 非金属元素的单质可以置换出非金属单质,但不能置换出金属单质 | |
| B. | Na2CO3和SiO2加热生成CO2,说明H2SiO3的酸性比H2CO3的强 | |
| C. | 液氨不能导电,所以液氨是非电解质,氨水能够导电,所以氨水是电解质 | |
| D. | S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
分析 A.非金属元素的单质可以置换出非金属单质,非金属单质也可能置换出金属单质;
B.常温下,水溶液中强酸能制取弱酸;
C.电解质是在水溶液中或熔融状态下能导电的化合物,非电解质是在水溶液中和熔融状态下均不能导电的化合物;
D.氧化还原反应中,化合价升高元素被氧化,所在的反应物是还原剂具有还原性,对应产物是氧化产物,化合价降低元素被还原,所在的反应物是氧化剂具有氧化性,对应产物是还原产物,S、Cl2均能和NaOH溶液发生氧化还原反应.
解答 解:A.非金属单质能置换出金属单质,氢气还原氧化铜生成铜和水,CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu,故A错误;
B.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故B错误;
C.氨水是氨气的水溶液,是混合物,既不是电解质也不是非电解质,故C错误;
D.3S+6NaOH $\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O,硫元素从硫单质中的0价变为Na2S-2价,硫单质是氧化剂,硫元素从硫单质中的0价变为Na2SO3+4价,硫是还原剂,所以既作氧化剂又作还原剂;Cl2+2NaOH=NaCl+NaClO+H2O,氯元素从氯气单质中的0价变为NaCl-1价,氯气单质是氧化剂,氯元素从氯气单质中的0价变为NaClO+1价,氯气是还原剂,所以既作氧化剂又作还原剂,故D正确;
故选D.
点评 本题考查非金属化合物知识,侧重考查硅、硫氯等知识、注意Cl2和NaOH溶液反应高频考点,注意电解质、氧化剂、还原剂的判断,题目难度中等.

练习册系列答案
相关题目
15.在有机物分子结构的鉴定中常用核磁共振氢谱分析法来测定有机化合物分子( )
| A. | 相对分子质量 | B. | 氢原子在碳骨架上的位置和数目 | ||
| C. | 含有何种化学键或官能团 | D. | 键长、键角及分子的三维结构 |
16.将2.24L(标准状况)乙烯和甲烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.1g,则原混合气体中乙烯与甲烷的物质的量之比为( )
| A. | 1:1 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
13.下列实验操作错误的是( )
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 用向上排空气法可以收集NO气体 | |
| C. | 配制硫酸亚铁溶液时,要加入适量的铁粉和稀硫酸 | |
| D. | 配制浓H2SO4和浓HNO3的混酸时,应将H2SO4慢慢加到浓HNO3中,并及时搅拌和冷却 |
10.下列关于氮及其化合物的说法正确的是( )
| A. | N2分子的结构稳定,因而氮气不能支持任何物质的燃烧 | |
| B. | 液氨汽化时要吸收大量热,因而液氨可用作制冷剂 | |
| C. | NO可用向上排空气法或者排水法收集 | |
| D. | 浓硝酸保存在棕色瓶内是因为硝酸易挥发 |
14.将铜投入一定量的稀硝酸中,铜完全溶解后,测得反应后溶液中Cu2+和NO3-的物质的量之比为3:7,则参加反应的HNO3与反应前HNO3的物质的量之比是( )
| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
15.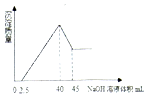 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |