题目内容
2.某课题组研究以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3•6H2O)的工艺,其设计的流程如下: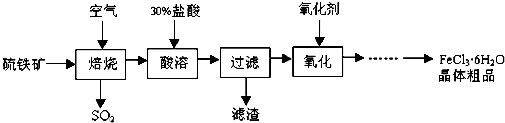
回答下列问题:
(1)已知在焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+6SO2;
(2)“酸溶”中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)“过滤”后滤液中金属阳离子有Fe3+、Fe2+;
(4)“氧化”中使用的氧化剂最好是Cl2(或H2O2等);
(5)该工艺流程中产生的SO2会污染空气并形成酸雨,下列物质:①BaCl2 ②品红③石灰乳 ④O2,用于吸收SO2最好的是③.
分析 由以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体的流程可知,在焙烧时FeS2与氧气反应生成四氧化三铁和二氧化硫,然后四氧化三铁溶于盐酸生成氯化铁,过滤后滤液中加氧化剂氯气(或氯水等),除去混有的亚铁离子,最后结晶制备晶体,以此解答该题.
解答 解:(1)焙烧硫铁矿石过程中铁元素转化成了Fe3O4,则该反应的化学方程式是3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+6SO2,故答案为:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+6SO2;
(2)“酸溶”中反应的离子方程式是Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)由(2)可知“过滤”后滤液中金属阳离子有Fe3+、Fe2+,故答案为:Fe3+、Fe2+;
(4)由(3)可知,氧化的目的是除去亚铁离子,且不引入新杂质,则“氧化”中使用的氧化剂最好是Cl2(或H2O2等),故答案为:Cl2(或H2O2等);
(5)工业一般用石灰乳吸收二氧化硫,以此可制备脱硫石膏,二氧化硫与氯化钡不反应,而品红只能用于检验,故答案为:③.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的分析,题目难度不大.

练习册系列答案
相关题目
14.将铜投入一定量的稀硝酸中,铜完全溶解后,测得反应后溶液中Cu2+和NO3-的物质的量之比为3:7,则参加反应的HNO3与反应前HNO3的物质的量之比是( )
| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
15.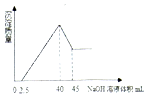 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
12.用足量的过氧化钠分别与水、二氧化碳、盐酸、硫酸发生反应,若生成的气体体积相同(同温同压)时,则得到的产物NaOH、Na2CO3、NaCl、Na2SO4的物质的量之比为( )
| A. | 2:1:2:1 | B. | 1:2:1:2 | C. | 4:2:2:1 | D. | 1:2:2:1 |
19.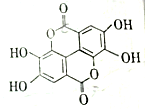 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )| A. | 酚 | B. | 醛 | C. | 芳香族化合物 | D. | 羧酸 |
7.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | Al溶于某强酸失去2mol电子,一定产生2gH2 | |
| B. | 0.1mol肼(N2H4)中共用电子对教目为0.5NA | |
| C. | 64.0gSO2与足量O2生成SO3电子转移教为2NA | |
| D. | 2L0.5mol/L硫酸钾溶液阴离子电荷数为2NA |
14.下面为测定稀盐酸与稀NaOH溶液反应的中和热的实验.
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸溶液的物质的量浓度为1.0mol•L-1,NaOH溶液的物质的量浓度为1.1mol•L-1,密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-56.0kJ/mol.
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
11.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |