题目内容
6.将8gFe2O3投入150mL的稀硫酸中,再投入7g铁粉,共收集到1.68L氢气(标准状况下),同时固体均无剩余,向溶液中滴入KSCN溶液,未见颜色变化.为了中和多余的硫酸,且使Fe2+全部转化为Fe(OH)2沉淀,共消耗4mol/L的NaOH溶液150mL,则原硫酸的物质的量浓度为( )mol/L.| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 同时固体均无剩余,向溶液中滴入KSCN溶液,未见颜色变化,溶质为FeSO4,为了中和多余的硫酸,且使Fe2+全部转化为Fe(OH)2沉淀,则存在H2SO4~2NaOH,以此计算.
解答 解:加Fe反应后溶液的溶质为硫酸亚铁、硫酸,为了中和多余的硫酸,且使Fe2+全部转化为Fe(OH)2沉淀,溶质为硫酸钠,由硫酸根离子守恒可知,
H2SO4~2NaOH,
1 2
0.15L×c 4mol/L×0.15L
$\frac{1}{2}=\frac{0.15L×c}{4mol/L×0.15L}$
解得c=2mol/L,
故选B.
点评 本题考查混合物的计算,为高频考点,把握酸碱恰好中和时Fe2+全部转化为Fe(OH)2沉淀为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
16.将2.24L(标准状况)乙烯和甲烷的混合气体通入足量的溴水中,充分反应后,溴水的质量增加了2.1g,则原混合气体中乙烯与甲烷的物质的量之比为( )
| A. | 1:1 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
14.将铜投入一定量的稀硝酸中,铜完全溶解后,测得反应后溶液中Cu2+和NO3-的物质的量之比为3:7,则参加反应的HNO3与反应前HNO3的物质的量之比是( )
| A. | 1:l | B. | 8:9 | C. | 3:4 | D. | 6:7 |
1.下列说法不正确的是( )
| A. | C7H16主链上有5个碳原子的同分异构体有5种 | |
| B. | 按系统命名法,化合物的名称是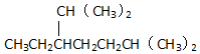 2,6-二甲基-3-乙基庚烷 2,6-二甲基-3-乙基庚烷 | |
| C. | 乙炔分子的球棍模型: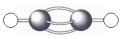 | |
| D. | 卤代烃加入硝酸酸化的硝酸银溶液根据生成的卤化银沉淀颜色检验卤原子 |
15.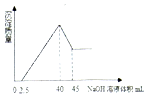 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
 取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )
取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示.则原H2SO4物质的量浓度是( )| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 4mol/L |
14.下面为测定稀盐酸与稀NaOH溶液反应的中和热的实验.
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸溶液的物质的量浓度为1.0mol•L-1,NaOH溶液的物质的量浓度为1.1mol•L-1,密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-56.0kJ/mol.
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
 现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.
现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.