题目内容
11.下列说法正确的是( )| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
分析 A.石油中主要含有碳元素和氢元素,还含有少量的氮元素、硫元素、氧元素;
B.混合物是指由多种物质组成的物质;
C.石油裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,根据石油的裂解和裂化的目的进行解答;
D.裂化汽油中含不饱和烃,可发生加成反应.
解答 解:A.石油中主要含有碳元素和氢元素,还含有少量的氮元素、硫元素、氧元素及微量金属元素(镍、钒、铁、锑等)等,故A错误;
B.分馏石油得到的各个馏分为烃类物质的混合物,故B错误;
C.石油裂化的目的是为了提高轻质液体燃料(汽油,煤油,柴油等)的产量,特别是提高汽油的产量,裂解的目的是为了获得乙烯、丙烯、丁二烯、丁烯、乙炔等,故C错误;
D.裂化汽油中含不饱和烃,可发生加成反应,不宜用作卤素的萃取剂,故D正确.
故选D.
点评 本题考查裂化和裂解的原理和产物,难度不大,注意裂解石油裂化和裂解都可以得到不饱和烃.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
2.下列说法正确的是( )
| A. | 沸点得到小:HI>HBr>HCl>HF | |
| B. | 干冰升华克服的是分子间作用力 | |
| C. | HF稳定性很强,是因为分子间能形成氢键 | |
| D. | 冰、水和水蒸气中都存在氢键 |
19.在相同温度下,体积相等且pH均等于3的盐酸和醋酸溶液,分别加蒸馏水稀释100倍后,下列分析中正确的是( )
| A. | 二者的pH仍然相等且均为5 | B. | 盐酸的pH大 | ||
| C. | 醋酸的pH大 | D. | 盐酸的pH为5,醋酸的pH在3~5之间 |
6.某酸性工业废水,可能含有Fe3+、Fe2+、Cu2+、Ca2+、Cl-、NO3-、Br-、I-中的一种或几种,为了能回收其中的某些成分,进行了以下实验: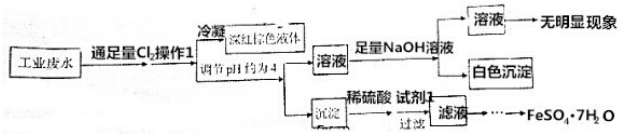
已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )

已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |
6.酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法.某学生用0.1032mol•L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)重复三次的实验数据如下表所示:
则待测HCl的物质的量浓度是0.1149mol•L-1.
(3)滴定至终点的现象是溶液由无色变为浅红色,且半分钟内不褪色.
(4)下列操作中可能使所测盐酸的浓度数值偏低的是D.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为
(Cl-)>c(NH4+)>c(H+)>c(OH-).
(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
(3)滴定至终点的现象是溶液由无色变为浅红色,且半分钟内不褪色.
(4)下列操作中可能使所测盐酸的浓度数值偏低的是D.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为
(Cl-)>c(NH4+)>c(H+)>c(OH-).
 .
.