题目内容
1.提纯下列物质(括号内为杂质)①NaCl(KNO3)固体中提取NaCl固体:加水溶解,蒸发结晶,趁热过滤.
②KNO3(NaCl)溶液中得KNO3固体:蒸发浓缩,冷却结晶,过滤.
③乙醇(水)混合物中得无水乙醇:加入CaO,再蒸馏.
④溴苯(溴)混合物中得溴苯:加入NaOH溶液,再分液.
分析 ①二者溶解度受温度影响不同;
②硝酸钾的溶解度受温度影响大;
③加CaO与水反应后,增大与乙醇的沸点差异;
④溴与NaOH溶液反应后,与溴苯分层.
解答 解:①二者溶解度受温度影响不同,分离方法为加水溶解,蒸发结晶,趁热过滤得到固体NaCl,故答案为:加水溶解,蒸发结晶,趁热过滤;
②硝酸钾的溶解度受温度影响大,则分离方法为蒸发浓缩,冷却结晶,过滤得到固体硝酸钾,故答案为:蒸发浓缩,冷却结晶,过滤;
③加CaO与水反应后,增大与乙醇的沸点差异,则分离方法为加入CaO,再蒸馏,故答案为:加入CaO,再蒸馏;
④溴与NaOH溶液反应后,与溴苯分层,则分离方法为加入NaOH溶液,再分液,故答案为:加入NaOH溶液,再分液.
点评 本题考查混合物分离提纯,为高频考点,把握混合物分离提纯原理、物质的性质、性质差异等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
11.某元素的原子核外有三个电子层,其最外层电子数是内层电子总数的一半,则此元素是( )
| A. | Si | B. | P | C. | S | D. | Cl |
12.为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验.
请回答下列问题:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:
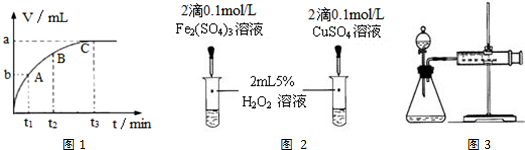
①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
请回答下列问题:
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:

①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
9.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A. | 单质的熔点:X>Y | |
| B. | 最高价氧化物对应的水化物的酸性:W>Y | |
| C. | 4种元素的单质中,W单质的熔、沸点最高 | |
| D. | 干燥的W单质具有漂白性 |
16.恒温恒容的密闭容器中发生如下反应:2A(g)+B(s)?C(g)+D(g),当下列物理量不再发生变化时:①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④C的物质的量浓度,上述反应一定达到平衡状态的是( )
| A. | ②③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
6.下列有关表达式中不正确的是( )
| A. | 乙烷的电子式: | B. | 乙烯的结构式: | ||
| C. | 乙醇的实验式:CH3O | D. | 乙酸的结构简式:CH3COOH |
13.下列各反应属于加成反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 氢气和氯气光照下生成氯化氢 | |
| C. | 乙炔和氢气在催化剂下合成乙烷 | |
| D. | 乙烷和氯气光照下生成多氯代物和氯化氢 |
10.由环己醇制取己二酸己二酯,最简单的流程途径顺序正确的是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
| A. | ①②⑤⑥ | B. | ⑤③④⑥ | C. | ⑤②③⑧ | D. | ②③④⑦ |
11.下列说法正确的是( )
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |