题目内容
2.下列说法正确的是( )| A. | 沸点得到小:HI>HBr>HCl>HF | |
| B. | 干冰升华克服的是分子间作用力 | |
| C. | HF稳定性很强,是因为分子间能形成氢键 | |
| D. | 冰、水和水蒸气中都存在氢键 |
分析 A.HF分子间含氢键,沸点最大,同类型分子的相对分子质量越大,沸点越大;
B.干冰升华为物理变化;
C.稳定性与化学键有关,氢键影响物理性质;
D.水蒸气不存在氢键.
解答 解:A.HF分子间含氢键,沸点最大,同类型分子的相对分子质量越大,沸点越大,则沸点为HF>HI>HBr>HCl,故A错误;
B.干冰升华为物理变化,则克服的是分子间作用力,故B正确;
C.稳定性与化学键有关,氢键影响物理性质,则HF稳定性很强与H-F键有关,故C错误;
D.水蒸气分子间距离较大,分子间作用力较弱,不存在氢键,故D错误;
故选B.
点评 本题考查晶体的性质以及氢键等知识,为高考常见题型和高频考点,侧重于学生的分析能力和基本概念的综合理解和运用的考查,题目难度不大,注意相关基础知识的积累.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
12.为了探究外界条件对过氧化氢分解速率的影响,某化学兴趣小组的同学做了以下实验.
请回答下列问题:
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:
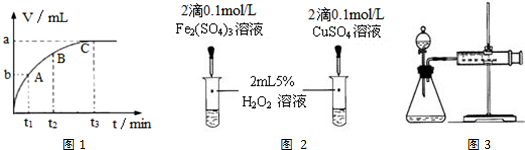
①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
请回答下列问题:
| 编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5%H2O2溶液,各滴入3滴 1mol/LFeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增多. |
| ② | 另取两支试管分别加入5mL5%H2O2溶液和5mL10%H2O2 溶液 | 两支试管中均未明显见到有 气泡产生. |
(2)实验①的目的是究温度对H2O2分解速率的影响;.
(3)实验②未观察到预期的实验现象,为了帮助该组同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入适量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是C(填字母代号).
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该兴趣化学小组的同学分别设计了如图2、3所示的实验.请回答相关问题:

①定性分析:如图2可通过观溶液中气泡产生的速率,定性比较得出结论;该实验中将FeCl3溶液改为Fe2(SO4)3溶液的原因是排除氯离子的干扰.
②定量分析:用图3所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是在同温同压下,收集40mL气体所需的时间.
(6)通过对上述实验过程的分析,在实验设计时,要考虑控制变量(或对比)方法的应用.
13.下列各反应属于加成反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 氢气和氯气光照下生成氯化氢 | |
| C. | 乙炔和氢气在催化剂下合成乙烷 | |
| D. | 乙烷和氯气光照下生成多氯代物和氯化氢 |
10.由环己醇制取己二酸己二酯,最简单的流程途径顺序正确的是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦中和反应 ⑧缩聚反应.
| A. | ①②⑤⑥ | B. | ⑤③④⑥ | C. | ⑤②③⑧ | D. | ②③④⑦ |
7.短周期元素W、X、Y、Z的原子序数依次增大,且质子数之和为36.它们可组成离子化合物Y2X和共价化合物ZX3,已知X、Z同主族,下列说法正确的是( )
| A. | 离子半径:Y>Z>X | |
| B. | 阴离子的还原性:W>Z | |
| C. | W和其他3种元素均能形成共价化合物 | |
| D. | X、Y、Z三种元素组成的化合物水溶液一定显碱性 |
14.室温下,CH3COOH的Ka=1.7×10-5mol•L-1,NH3•H2O的Kb=1.7×10-5mol•L-1,下列说法不正确的是( )
| A. | 室温下,相同浓度的CH3COOH与NH3•H20的电离程度相同 | |
| B. | 温度改变后,Ka、Kb都会发生改变 | |
| C. | 室温下,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 | |
| D. | 室温下,相同物质的量浓度时,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 |
11.下列说法正确的是( )
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
15.下列化学用语对应正确的是( )
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |