题目内容
6.某酸性工业废水,可能含有Fe3+、Fe2+、Cu2+、Ca2+、Cl-、NO3-、Br-、I-中的一种或几种,为了能回收其中的某些成分,进行了以下实验: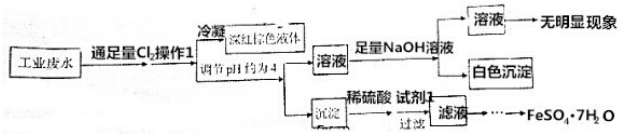
已知pH=4时,Fe3+沉淀完全,而Cu2+、Ca2+未沉淀.
下列说法不正确的是( )
| A. | 该工业废水中肯定存在Cu2+、I- | |
| B. | 若废水中存在NO3-,则肯定存在Fe3+ | |
| C. | 操作1为鼓入热空气,试剂1为Fe | |
| D. | 为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥 |
分析 废水中通入足量氯气的目的是将溶液中还原性较强的离子氧化,可能氧化Fe2+、Br-、I-,操作1为鼓入热空气,吹出溴蒸气,冷凝后有深红棕色液体生成,说明是液溴,则可推断出原废水中含Br-; 调节溶液PH约为4,Fe3+沉淀完全,得到氢氧化铁沉淀,加稀硫酸后氢氧化铁沉淀溶解,试剂1为铁,将三价铁离子还原为二价铁离子,为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥; 加足量氢氧化钠溶液产生白色沉淀,说明原废水中不含Cu2+,含Ca2+,白色沉淀是氢氧化钙,在加足量氢氧化钠溶液后溶液无明显现象,说明溶液中无碘,原废水中不含I-;氯离子不能确定; 由于废水呈酸性,若含有NO3-、就不能有还原性二价铁离子,只能是三价铁离子,有二价铁离子,就不能有NO3-.
解答 解:废水中通入足量氯气的目的是将溶液中还原性较强的离子氧化,可能氧化Fe2+、Br-、I-,操作1为鼓入热空气,吹出溴蒸气,冷凝后有深红棕色液体生成,说明是液溴,则可推断出原废水中含Br-; 调节溶液PH约为4,Fe3+沉淀完全,得到氢氧化铁沉淀,加稀硫酸后氢氧化铁沉淀溶解,试剂1为铁,将三价铁离子还原为二价铁离子,为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥; 加足量氢氧化钠溶液产生白色沉淀,说明原废水中不含Cu2+,含Ca2+,白色沉淀是氢氧化钙,在加足量氢氧化钠溶液后溶液无明显现象,说明溶液中无碘,原废水中不含I-;氯离子不能确定; 由于废水呈酸性,若含有NO3-、就不能有还原性二价铁离子,否者会发生氧化还原反应,只能是三价铁离子; 若有二价铁离子,就不能有NO3-,
A.根据上述分析可知,溶液中不含Cu2+、I-,故A错误;
B.由于废水呈酸性,若含有NO3-,就不能有还原性二价铁离子,否者会发生氧化还原反应,只能是三价铁离子; 若有二价铁离子,就不能有NO3-,若废水中存在NO3-,则肯定存在Fe3+,故B正确;
C.操作1为鼓入热空气,吹出溴蒸气;试剂1为铁,将三价铁离子还原为二价铁离子,是为后面得到FeSO4•7H2O服务,故C正确;
D.为了得到FeSO4•7H2O,需要经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥,故D正确;
故选A.
点评 本题结合化工工艺流程对中学常见离子进行检验,注意所加试剂的目的,常见离子以及物质的性质是答题的关键,一些困难问题还需要顺向思维与逆向思维相结合,本题有一定的难度.

| A. | ②③ | B. | ②④ | C. | ②③④ | D. | ①③④ |
| A. | 室温下,相同浓度的CH3COOH与NH3•H20的电离程度相同 | |
| B. | 温度改变后,Ka、Kb都会发生改变 | |
| C. | 室温下,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 | |
| D. | 室温下,相同物质的量浓度时,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 |
| A. | F2 | B. | H2O | C. | PCl3 | D. | SO2 |
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 35 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)上述反应中,反应物的总能量比生成物的总能量高(选填“高”、“低”或“相等”).
(2)实验l、2可得出的结论是反应物浓度越大,反应速率越快;实验3、4可得出的结论是反应温度越高,反应速率越快.
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁强(选填“强”或“弱”),铁电极上发生的电极反应式为2H++2e-=H2↑.
| A. | 实验室可以用酒精或CS2清洗残留的S | |
| B. | 除去CO2中SO2可以用碳酸钠溶液 | |
| C. | 可以用硝酸酸化的氯化钡检验硫酸根离子 | |
| D. | CO2通入到BaCl2溶液中,溶液不变浑浊 |
 、
、 .
.