题目内容
4.根据下面的反应路线及所给信息填空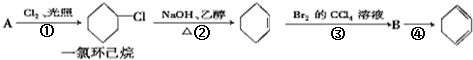
①反应②的反应类型是消去反应.
②一氯环己烷的一硝基取代产物有4种(不考虑立体异构).
③反应④的化学方程式
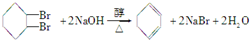 .
.
分析 由合成流程可知,反应①中A与氯气在光照的条件下发生取代反应生成一氯环己烷,故A为 ;由反应②可知一氯环己烷去掉HCl生成环己烯,为卤代烃的消去反应;③为加成反应,生成B为1,2-二溴环己烷,故反应④是1,2-二溴环己烷发生消去反应生成1,4-环己二烯,以此来解答.
;由反应②可知一氯环己烷去掉HCl生成环己烯,为卤代烃的消去反应;③为加成反应,生成B为1,2-二溴环己烷,故反应④是1,2-二溴环己烷发生消去反应生成1,4-环己二烯,以此来解答.
解答 解:由合成流程可知,反应①中A与氯气在光照的条件下发生取代反应生成一氯环己烷,故A为 ;由反应②可知一氯环己烷去掉HCl生成环己烯,为卤代烃的消去反应;③为加成反应,生成B为1,2-二溴环己烷,故反应④是1,2-二溴环己烷发生消去反应生成1,4-环己二烯,
;由反应②可知一氯环己烷去掉HCl生成环己烯,为卤代烃的消去反应;③为加成反应,生成B为1,2-二溴环己烷,故反应④是1,2-二溴环己烷发生消去反应生成1,4-环己二烯,
①由上述分析可知,反应②的反应类型是消去反应,故答案为:消去反应;
②一氯环己烷中H被硝基取代,存在邻、间、对三种,或-Cl被硝基取代,共4种,故答案为:4;
③反应④的化学方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握有机合成流程中的官能团变化、有机反应为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列说法正确的是( )
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
15.下列化学用语对应正确的是( )
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |
12.下列变化规律的叙述中,正确的是( )
| A. | F-、Cl-、Br-、I-的还原性逐渐减弱 | B. | NaOH、KOH、RbOH的碱性逐渐减弱 | ||
| C. | Li、Na、K、Rb、Cs的金属性逐渐减弱 | D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
19.下列说法正确的是( )
| A. | 实验室可以用酒精或CS2清洗残留的S | |
| B. | 除去CO2中SO2可以用碳酸钠溶液 | |
| C. | 可以用硝酸酸化的氯化钡检验硫酸根离子 | |
| D. | CO2通入到BaCl2溶液中,溶液不变浑浊 |
9.下列有关电解质的说法正确的是( )
| A. | 强电解质的溶液一定比弱电解质的溶液导电性强 | |
| B. | 易溶性强电解质的溶液中不存在溶质分子 | |
| C. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| D. | 由于硫酸钡难溶于水,所以是弱电解质 |
13.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 2NO(g)+2CO(g)=N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H<0 | |
| D. | 电解MgCl2饱和溶液,可制得金属镁 |
14.下表是元素周期表中的一部分:
根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)A分别与D、E、F、G、H形成的化合物中显碱性的是NH3,最稳定的是HF.
(3)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(4)B、C、H三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(2)A分别与D、E、F、G、H形成的化合物中显碱性的是NH3,最稳定的是HF.
(3)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(4)B、C、H三种元素的最高价氧化物对应水化物两两间反应的化学方程式分别为:Al(OH)3+NaOH=NaAlO2+2H2O;H2SO4+2NaOH=Na2SO4+2H2O;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.