题目内容
6.酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法.某学生用0.1032mol•L-1的氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取25.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准NaOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)重复三次的实验数据如下表所示:
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
(3)滴定至终点的现象是溶液由无色变为浅红色,且半分钟内不褪色.
(4)下列操作中可能使所测盐酸的浓度数值偏低的是D.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和时,该溶液中离子浓度大小关系为
(Cl-)>c(NH4+)>c(H+)>c(OH-).
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)先根据数据的有效性,然后求出平均消耗V(氢氧化钠),再根据反应HCl+NaOH═NaCl+H2O求出c(盐酸);
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和,得氯化铵溶液,据此确定溶液中各离子的物质的量浓度由大到小的顺序.
解答 解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:BDCEAF;
故答案为:BDCEAF;
(2)三次滴定消耗氢氧化钠溶液的体积为:28.84mL,27.83mL,27.85mL,第1组数据无效,则平均消耗V(氢氧化钠)=27.84mL,
HCl+NaOH═NaCl+H2O
25.00ml×c(盐酸) 27.84mL×0.1032mol•L-1
解得:c(盐酸)=0.1149mol•L-1
故答案为:0.1149;
(3)用标准NaOH溶液滴定盐酸溶液,用酚酞作指示剂,所以终点时,当滴入最后一滴氢氧化钠溶液后,溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故A错误;
B、滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C、碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故C错误;
D、读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏低,故D正确;
故答案为:D;
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和,得氯化铵溶液,溶液中各离子的物质的量浓度由大到小的顺序是:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题主要考查酸、碱滴定实验的基本操作,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 氢气和氯气光照下生成氯化氢 | |
| C. | 乙炔和氢气在催化剂下合成乙烷 | |
| D. | 乙烷和氯气光照下生成多氯代物和氯化氢 |
| A. | 室温下,相同浓度的CH3COOH与NH3•H20的电离程度相同 | |
| B. | 温度改变后,Ka、Kb都会发生改变 | |
| C. | 室温下,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 | |
| D. | 室温下,相同物质的量浓度时,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 |
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 35 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)上述反应中,反应物的总能量比生成物的总能量高(选填“高”、“低”或“相等”).
(2)实验l、2可得出的结论是反应物浓度越大,反应速率越快;实验3、4可得出的结论是反应温度越高,反应速率越快.
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡.该金属的金属活动性比铁强(选填“强”或“弱”),铁电极上发生的电极反应式为2H++2e-=H2↑.
(1)将称量好的8.8g烧碱样品配制成500mL待测液,配制过程使用的主要仪器除500mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:当滴入最后一滴盐酸,溶液由红色变为无色,且半分钟内不褪色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是BC(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Cl-)+c(Na+)>c(OH-)+c(H+)
(5)根据下列数据计算,c(NaOH)0.40mol/L
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
A.滴定前平视,滴定后俯视
B.未用标准液润洗滴定管
C.用待测液润洗锥形瓶
D.不小心将标准液滴在锥形瓶外面.
| A. | NH4Cl的电子式: | B. | 甲烷的结构式: | C. | H2O2的电子式: | D. | CCl4的电子式: |
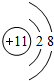
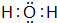 、
、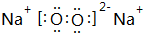 .
.