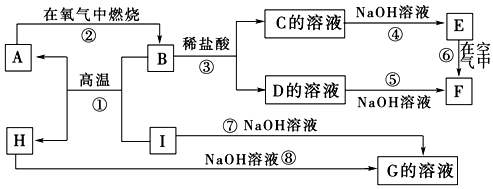
题目内容
16.以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、SiO2等杂质]为主要原料生产重要铬铁矿KClO3、纯碱CO2氧化剂重铬酸钠晶体(Na2Cr2O7•2H2O)的主要工艺流程如图: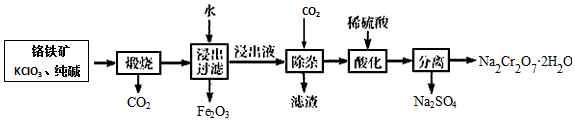
(1)浸出液中的主要成分为Na2CrO4.写出煅烧时主要成分[Fe(CrO2)2]发生反应的化学方程式6Fe(CrO2)2+7KClO3+12Na2CO3=12Na2CrO4+7KCl+3Fe2O3+12CO2↑;同时杂质Al2O3、SiO2液转化为可溶性盐,在浸出液中分别以AlO2-、SiO32-(离子符号)存在.
(2)酸化的目的是将Na2CrO4转化为Na2Cr2O7.写出反应的离子方程式:2CrO42-+2H+=Cr2O72-+H2O;
通过结晶分离得到的Na2Cr2O7•2H2O中可能含有的杂质除了Na2SO4外,还有KCl(或K2SO4\NaCl).
进一步提纯的方法是重结晶.
(3)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放.含CrO42-的废水处理通常有以下两种方法.
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+.加入可溶性钡盐后的废水中Ba2+的浓度应不小于2.4×10-4mol/L,后续废水处理方能达到国家排放标准.
②还原法:CrO42-$→_{H+}^{绿矾}$Cr3+$\stackrel{石灰水}{→}$Cr(OH)3.用该方法处理10m3 CrO42-的物质的量浓度为1.5×10-3mol/L的废水,至少需要绿矾(FeSO4•7H2O)12.5kg.
分析 以铬铁矿[主要成分为Fe(CrO2)2,含有Al2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7•2H2O):铬铁矿在空气中与纯碱煅烧生成Na2CrO4和CO2气体,反应为:6Fe(CrO2)2+7KClO3+12Na2CO3=12Na2CrO4+7KCl+3Fe2O3+12CO2↑,同时A12O3+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,铬铁矿与纯碱、KClO3煅烧生成物通过水浸Na2SiO3、Na2CrO4、NaAlO2进入浸出液中,而不溶的Fe2O3形成滤渣,浸出液通过除杂,通入CO2气体,形成滤渣硅酸、Al(OH)3沉淀,最后分离出Na2CrO4溶液,经过酸化、过滤、结晶得到最终产品重铬酸钠晶体( Na2Cr2O7•2H2O);
(3)①根据沉淀溶解平衡CrO42-+Ba2+?BaCrO4及Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=1.2×10-10,可得C(Ba2+);
②根据电子守恒列关系式:CrO42-~3FeSO4•7H2O,可得FeSO4•7H2O的物质的量进而求质量.
解答 解:(1)浸出液中的主要成分为Na2CrO4,由流程可知还有二氧化碳、氧化铁的生成,故煅烧时主要成分[Fe(CrO2)2]发生反应的化学方程式为:6Fe(CrO2)2+7KClO3+12Na2CO3=12Na2CrO4+7KCl+3Fe2O3+12CO2↑,同时A12O3+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,杂质Al2O3、SiO2液转化为可溶性盐,在浸出液中分别以存在AlO2-、SiO32-;
故答案为:6Fe(CrO2)2+7KClO3+12Na2CO3=12Na2CrO4+7KCl+3Fe2O3+12CO2↑;AlO2-;SiO32-;
(2)酸化的目的是将Na2CrO4转化为Na2Cr2O7,离子方程式为:2CrO42-+2H+=Cr2O72-+H2O;流程中钾离子、氯离子、硫酸根离子、钠离子未除去,故产品中还可能含有 KCl(或K2SO4\NaCl),可通过重结晶进一步提纯;
故答案为:2CrO42-+2H+=Cr2O72-+H2O; KCl(或K2SO4\NaCl);重结晶;
(3)①CrO42-+Ba2+?BaCrO4
5.0×10-7mol•L-1 C(Ba2+)
Ksp(BaCrO4)=C(CrO42-)×C(Ba2+)=5.0×10-7×C(Ba2+)=1.2×10-10,
C(Ba2+)=2.4×10-4mol/L;
故答案为:2.4×10-4;
②CrO42-$→_{H+}^{绿矾}$Cr3+,CrO42-中的Cr化合价由+6价降为+3价,FeSO4•7H2O中铁的化合价由+3价降为+2价,
则有:CrO42-~~~~~~3FeSO4•7H2O
1 3
104L×1.5×10-3 mol•L-1 45mol
所以FeSO4•7H2O的质量为:45mol×278g/mol=12510g=12.5kg;
故答案为:12.5.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.

| A. | H2CO3?H2O+CO2↑ | B. | KOH═K++O2-+H+ | ||
| C. | HClO═H++ClO- | D. | Na2CO3═2Na++CO32- |
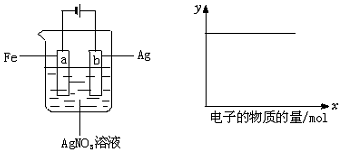
(1)c(Ag+) (2)c(NO3-) (3)a棒的质量 (4)b棒的质量 (5)溶液的pH.
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
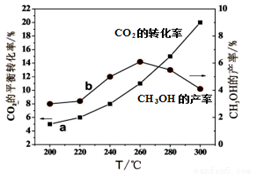
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
| A. | Zn与稀H2SO4反应:2Zn+2H+═2Zn2++H2↑ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ | |
| D. | 硫酸氢钠溶液与过量氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
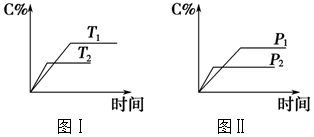
| A. | 化学方程式中m+n<e+f | |
| B. | 达平衡后,若升温,平衡左移 | |
| C. | 达平衡后,加入催化剂则C%增大 | |
| D. | 达平衡后,增加A的量有利于平衡向右移动 |
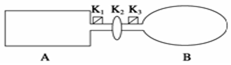 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g)?N2O4(g)△H<0)