题目内容
11. 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=+41.19 kJ•mol-1,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=$\frac{{K}_{1}}{{K}_{3}}$(用K1、K3表示).
(2)反应Ⅲ自发进行条件是较低温度(填“较低温度”、“较高温度”或“任何温度”).
(3)在一定条件下2L恒容密闭容器中充入3mol H2和1.5mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如表所示.
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60% | 40% |
②温度为500℃时,该反应10min时达到平衡:
a.用H2表示该反应的速率为0.135mol•L-1•min-1;
b.该温度下,反应I的平衡常数K=200L2/mol2.
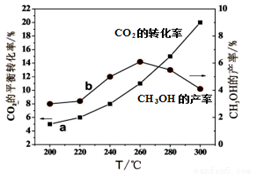
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示.
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是BD(选填编号).
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而增大(填“增大”、“减小”、“不变”或“无法判断”).
分析 (1)根据盖斯定律:Ⅱ=Ⅰ-Ⅲ得反应②的△H2;所以平衡常数则K2=$\frac{{K}_{1}}{{K}_{3}}$;
(2)化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自发进行,据此解答;
(3)①正反应是放热反应,所以升高温度二氧化碳的转化率减小;
②a.根据v=$\frac{△c}{△t}$计算;
b.平衡常数等于平衡时生成物浓度幂之积比上反应物浓度幂之积;
(4)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1,反应Ⅱ:CO2(g)+H2(g)?CO(g)+H2O(g)△H2,反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,根据盖斯定律:Ⅱ=Ⅰ-Ⅲ得反应②的△H2=+41.19 kJ•mol-1,所以平衡常数则K2=$\frac{{K}_{1}}{{K}_{3}}$;
故答案为:+41.19 kJ•mol-1;$\frac{{K}_{1}}{{K}_{3}}$;
(2)△G=△H-T•△S<0时,反应能够自发进行,该反应的△S<0、△H<0,当温度较低时,反应Ⅲ能够自发进行,
故答案为:较低温度;
(3)①正反应是放热反应,所以升高温度二氧化碳的转化率减小,则温度越低转化率越大,即T 高于500℃,故答案为:高于;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初起量:1.5mol 3mol 0 0
变化量:0.9mol 2.7mol 0.9mol 0.9mol
平衡量:0.6mol 0.3mol 0.9mol 0.9mol
a.v=$\frac{\frac{2.7}{2}}{10}$=0.135 mol•L-1•min-1,故答案为:0.135 mol•L-1•min-1;
b.K=$\frac{\frac{0.9}{2}×\frac{0.9}{2}}{\frac{0.6}{2}×(\frac{0.3}{2})^{3}}$=200 L2/mol2,故答案为:200 L2/mol2;
(4)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
B.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
C.分离出甲醇,不能加快反应速率,故错误;
D.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选BD;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 单质钠具有很强的还原性,钠离子具有很弱的氧化性 | |
| C. | Na着火时不能用水灭火,可用细沙覆盖灭火 | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
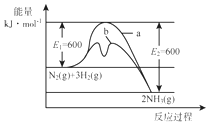 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.(1)根据图1提供的信息,写出该反应的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.在图1中曲线b(填“a”或“b”)表示加入铁触媒的能量变化曲线.
(2)在恒容器中,下列描述中能说明上述反应已达平衡的是BDE.
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
E.断开一个氮氮键同时形成3个氢氢键
F.C(N2):C(H2):C(NH3)=1:3:2
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中NH3的体积分数$\frac{1}{9}$,则平均反应速率v(N2)=0.2mol/(L•min),该温度下的平衡常数K=$\frac{25}{432}$(用分数表示).如在该温度下向2L密闭容器中通入xmolN2、ymolH2、zmolNH3,使平衡向逆向移动,平衡后NH3的体积分数为573~637K时的反应时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
| A. | 23g乙醇含有碳氢键数为3NA | |
| B. | 标准状况下,2.24L SO3含有的分子数为0.1NA | |
| C. | 1mol 过氧化氢完全分解,电子转移数为1NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
| A. | 质子数为53,中子数为78的碘原子:53131I | |
| B. | CH4分子的比例模型: | |
| C. | Na+ 的结构示意图: | |
| D. | NaOH的电离方程式:NaOH?Na++OH- |