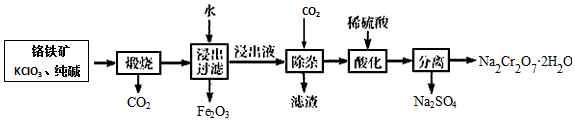
题目内容
8.A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出).已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素.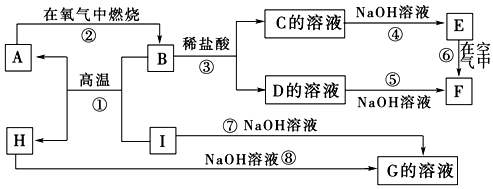
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁.
(2)反应①的化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe
反应③?的离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O
反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O
(3)反应⑥过程中的现象是生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色.
(4)1molI发生反应?后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占33.6L.
分析 H为主族元素的固态氧化物,H能和氢氧化钠溶液反应生成G,则H是Al2O3,I能和氢氧化钠溶液反应生成G,则I是Al,G是NaAlO2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,结合对应单质、化合物的性质解答该题.
解答 解:(1)由以上分析可知A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁,故答案为:铁;
(2)反应①是高温下铝和四氧化三铁反应生成氧化铝和铁,反应方程式为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,
反应③是四氧化三铁与盐酸反应生成氯化亚铁、氯化铁与水,反应离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O,
反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;Fe3O4+8H+=2Fe3++Fe2++4H2O;Al2O3+2NaOH=2NaAlO2+H2O;
(3)反应⑥是氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应现象是生成白色沉淀迅速变化为灰绿色最后变化为红褐色,故答案为:生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色;
(4)方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,可知1molAl生成$\frac{9}{8}$molFe,与水发生3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,可生成氢气的物质的量为$\frac{9}{8}$mol×$\frac{4}{3}$=1.5mol,体积为1.5mol×22.4L/mol=33.6L,
故答案为:33.6.
点评 本题考查无机物的推断,为高频考点,侧重考查学生的分析能力和推断能力,注意“F的颜色及I、H能与氢氧化钠反应”是推断突破口,再结合转化关系推断,难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 23g乙醇含有碳氢键数为3NA | |
| B. | 标准状况下,2.24L SO3含有的分子数为0.1NA | |
| C. | 1mol 过氧化氢完全分解,电子转移数为1NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |

已知:有关物质的性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
(1)仪器A的名称是球形干燥管,仪器A中盛装的试剂是碱石灰或生石灰、氢氧化钠,氯化钙等.
(2)CCl4的电子式为
 .
.(3)装置C处硬质玻管中反应的化学方程式为TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g).
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为TiCl4+2H2O=TiO2+4HCl.
(5)仪器N中收集到的物质主要有CCl4、TiCl4(写化学式),从产物中分离出TiCl4的实验方法是蒸馏.
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2:1的CO和CO2混合气体,该感应中氧化剂与还原剂的物质的量之比为4:3.请设计实验方案验证产物气体中有CO:将产物气体依序通入足量的NaOH溶液→干燥剂→灼热的CuO→澄清石灰水,若最终澄清石灰水变浑浊,灼热的CuO固体由黑色变红色,则产物中有CO.
| A. | 质子数为53,中子数为78的碘原子:53131I | |
| B. | CH4分子的比例模型: | |
| C. | Na+ 的结构示意图: | |
| D. | NaOH的电离方程式:NaOH?Na++OH- |
I.配制溶液(以NaOH溶液为例)
(1)实验需要0.5mol/L NaOH溶液245mL,则至少需要NaOH固体5.0g.
(2)配制NaOH溶液过程中,一定需要下列仪器中的填写仪器的标号)如图21
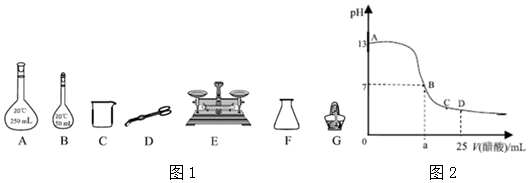
II.测定NaOH溶液与稀 H2SO4反应的中和热 取50mLNaOH溶液与30mL H2SO4溶液进行实验,测得数据如表:
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
(4)上述实验计算结果与一57.3kJ/mol存在偏差的原因可能是ACD(填序号)
A.实验装置保温、隔热效果差
B量取NaOH溶液体积时仰视读数
C.分多次将NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后,直接测定H2S04溶液的温度
III.向25mLNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示:
(5)写出NaOH溶液与CH3COOH溶液反应的离子方程式CH3COOH+OH-=CH3COO-+H2O.
(6)该NaOH溶液的物质的量浓度为0.1mol/L.
(7)当滴加CH3COOH溶液至D点时,所得混合溶 液中各离子浓度的大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).