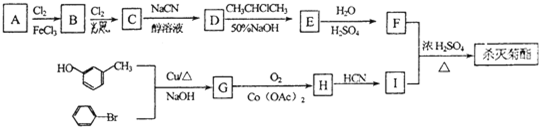
题目内容
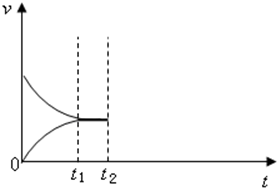 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.(1)该温度时乙容器中平衡体系的平衡常数是
(2)若保持甲容器的温度和压强不变,向甲容器的平衡体系再中通入0.9mol N2,则平衡将
(3)若达平衡时要使甲、乙两容器中NH3的体积分数相同,可以采取的措施是
A.保持温度不变,将乙容器内的压强增加到原来的1.5倍
B.保持温度不变,向乙容器中再充入0.6mol N2和0.5mol H2
C.升高乙容器的温度
D.保持甲容器的体积为1L不变,升高甲容器的温度
(4)若在t2時改变条件,请将按上述(3)中正确选项的条件改变后到再次达到平衡时的v-t关系在如图中画出(若有两个或两个以上的选项是正确的,任选1个画出即可,注意标明选项的符号和图中的v(正)和v(逆)).选项
(5)①有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制成新型燃料电池.请写出该电池的正极反应式
②氨气与光气(COCl2)作用可以得到尿素和一种盐,该盐的水溶液显酸性.氨气与光气反应的方程式为
(6)已知H2(g)、CO(g)、CH4(g)三种物质的燃烧热分别是-285.8kJ?mol-1、-283.0kJ?mol-1、-890.3kJ?mol-1,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.甲烷在高温下与水蒸气反应的化学方程式为:CH4(g)+H2O (g)═CO(g)+3H2(g).该反应的反应热△H=
考点:化学平衡的计算,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)甲和乙是相同温度下的化学平衡,平衡常数相同,计算甲反应平衡状态平衡常数即为乙反应平衡常数;
(2)依据浓度商和平衡常数比较分析判断平衡进行方向,注意甲容器是恒压容器,依据气体体积比等于气体物质的量之比计算体积;
(3)若达平衡时要使甲、乙两容器中NH3的体积分数相同,甲为恒压容器为保持压强不变,压强增大,和乙相比平衡正向进行,氨气的体积分数大于乙,若使氨气的体积分数相同,需要改变条件甲逆向进行或乙正向进行;
A.保持温度不变,将乙容器内的压强增加到原来的1.5倍,平衡正向进行,氨气含量增大,甲容器体积2L变化为1L,所以大于甲中氨气含量;
B.保持温度不变,向乙容器中再充入0.6mol N2和0.5mol H2,相当于氮气1,2mol,氢气物质的量为1mol,在2L容器中形成的平衡,和1L容器中甲形成的平衡状态中氨气体积分数相同;
C.反应是放热反应,升温平衡逆向进行,所以升高乙容器的温度,氨气体积分数更小;
D.保持甲容器的体积为1L不变,升高甲容器的温度,平衡逆向进行,可以达到和乙容器中氨气体积分数相同;
(4)B选项是加入反应物,此时正反应速率增大,逆反应速率不变,D选项中升温,正逆反应速率都增大,平衡逆向进行,据此画出变化图象;
(5)①原电池的正极上发生得电子的还原反应,据此书写电极反应.
②氨气与光气(COCl2)作用可以得到尿素和一种盐,该盐的水溶液显酸性为氯化铵,结合原则守恒书写化学方程式;
(6)①由外界条件对化学平衡以及化学反应速率的影响分析;
②根据燃烧热写出热化学方程式,利用盖斯定律计算.
(2)依据浓度商和平衡常数比较分析判断平衡进行方向,注意甲容器是恒压容器,依据气体体积比等于气体物质的量之比计算体积;
(3)若达平衡时要使甲、乙两容器中NH3的体积分数相同,甲为恒压容器为保持压强不变,压强增大,和乙相比平衡正向进行,氨气的体积分数大于乙,若使氨气的体积分数相同,需要改变条件甲逆向进行或乙正向进行;
A.保持温度不变,将乙容器内的压强增加到原来的1.5倍,平衡正向进行,氨气含量增大,甲容器体积2L变化为1L,所以大于甲中氨气含量;
B.保持温度不变,向乙容器中再充入0.6mol N2和0.5mol H2,相当于氮气1,2mol,氢气物质的量为1mol,在2L容器中形成的平衡,和1L容器中甲形成的平衡状态中氨气体积分数相同;
C.反应是放热反应,升温平衡逆向进行,所以升高乙容器的温度,氨气体积分数更小;
D.保持甲容器的体积为1L不变,升高甲容器的温度,平衡逆向进行,可以达到和乙容器中氨气体积分数相同;
(4)B选项是加入反应物,此时正反应速率增大,逆反应速率不变,D选项中升温,正逆反应速率都增大,平衡逆向进行,据此画出变化图象;
(5)①原电池的正极上发生得电子的还原反应,据此书写电极反应.
②氨气与光气(COCl2)作用可以得到尿素和一种盐,该盐的水溶液显酸性为氯化铵,结合原则守恒书写化学方程式;
(6)①由外界条件对化学平衡以及化学反应速率的影响分析;
②根据燃烧热写出热化学方程式,利用盖斯定律计算.
解答:
解:(1)甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为
,体积为1L;
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 0.6 0.5 0
变化量(mol) 0.1 0.3 0.2
平衡量(mol) 0.5 0.2 0.2
平衡浓度c(N2)=0.5mol/L,c(H2)=0.2mol/L,c(NH3)=0.2mol/L
K=
=10,所以乙容器中达到平衡的平衡常数为10;
故答案为:10;
(2)若保持甲容器的温度和压强不变,向甲容器的平衡体系再中通入0.9mol N2,体积之比扥故物质的量之比,此时气体体积V为:1:(0.5+02+0.2)=V:(0.5+0.9+0.2+0.2),V=2L,此时物质浓度为c(N2)=
=0.7mol/L,c(H2)=0.1mol/L,c(NH3)=0.1mol/L
Q=
=14.3>10,则平衡将逆向进行;
故答案为:逆向;
(3)若达平衡时要使甲、乙两容器中NH3的体积分数相同,甲为恒压容器为保持压强不变,压强增大,和乙相比平衡正向进行,氨气的体积分数大于乙,若使氨气的体积分数相同,需要改变条件甲逆向进行或乙正向进行;
A.保持温度不变,将乙容器内的压强增加到原来的1.5倍,平衡正向进行,氨气含量增大,甲容器体积2L变化为1L,所以大于甲中氨气含量,故A错误;
B.保持温度不变,向乙容器中再充入0.6mol N2和0.5mol H2,相当于氮气1,2mol,氢气物质的量为1mol,在2L容器中形成的平衡,和1L容器中甲形成的平衡状态中氨气体积分数相同,故B正确;
C.反应是放热反应,升温平衡逆向进行,所以升高乙容器的温度,氨气体积分数更小,故C错误;
D.保持甲容器的体积为1L不变,升高甲容器的温度,平衡逆向进行,可以达到和乙容器中氨气体积分数相同,故D正确;
故选BD.
(4)B选项是加入反应物,此时正反应速率增大,逆反应速率不变,D选项中升温,正逆反应速率都增大,平衡逆向进行,据此画出变化图象为:
 ;
;
故答案为: ;
;
(5)①以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+;
②氨气与光气(COCl2)作用可以得到尿素和一种盐,该盐的水溶液显酸性为氯化铵,反应的化学方程式为:4NH3+COCl2=CO(NH2)2+2NH4Cl;
故答案为:4NH3+COCl2=CO(NH2)2+2NH4Cl;
(6)根据题中信息可知:①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
②CO(g)+
O2(g)=CO2(g) )△H=-283.0kJ?mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ?mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ?mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ?mol-1)+(-890.3kJ?mol-1)-(-283.0kJ?mol-1)-3×(-285.8kJ?mol-1)=+206.1 kJ?mol-1;
故答案为:+206.1kJ/mol;
| 1 |
| 6 |
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 0.6 0.5 0
变化量(mol) 0.1 0.3 0.2
平衡量(mol) 0.5 0.2 0.2
平衡浓度c(N2)=0.5mol/L,c(H2)=0.2mol/L,c(NH3)=0.2mol/L
K=
| 0.22 |
| 0.5×0.23 |
故答案为:10;
(2)若保持甲容器的温度和压强不变,向甲容器的平衡体系再中通入0.9mol N2,体积之比扥故物质的量之比,此时气体体积V为:1:(0.5+02+0.2)=V:(0.5+0.9+0.2+0.2),V=2L,此时物质浓度为c(N2)=
| 0.5mol+0.9mol |
| 2L |
Q=
| 0.12 |
| 0.7×0.13 |
故答案为:逆向;
(3)若达平衡时要使甲、乙两容器中NH3的体积分数相同,甲为恒压容器为保持压强不变,压强增大,和乙相比平衡正向进行,氨气的体积分数大于乙,若使氨气的体积分数相同,需要改变条件甲逆向进行或乙正向进行;
A.保持温度不变,将乙容器内的压强增加到原来的1.5倍,平衡正向进行,氨气含量增大,甲容器体积2L变化为1L,所以大于甲中氨气含量,故A错误;
B.保持温度不变,向乙容器中再充入0.6mol N2和0.5mol H2,相当于氮气1,2mol,氢气物质的量为1mol,在2L容器中形成的平衡,和1L容器中甲形成的平衡状态中氨气体积分数相同,故B正确;
C.反应是放热反应,升温平衡逆向进行,所以升高乙容器的温度,氨气体积分数更小,故C错误;
D.保持甲容器的体积为1L不变,升高甲容器的温度,平衡逆向进行,可以达到和乙容器中氨气体积分数相同,故D正确;
故选BD.
(4)B选项是加入反应物,此时正反应速率增大,逆反应速率不变,D选项中升温,正逆反应速率都增大,平衡逆向进行,据此画出变化图象为:
 ;
;故答案为:
 ;
;(5)①以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池,N2在正极发生还原反应生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,
故答案为:N2+6e-+8H+=2NH4+;
②氨气与光气(COCl2)作用可以得到尿素和一种盐,该盐的水溶液显酸性为氯化铵,反应的化学方程式为:4NH3+COCl2=CO(NH2)2+2NH4Cl;
故答案为:4NH3+COCl2=CO(NH2)2+2NH4Cl;
(6)根据题中信息可知:①H2(g)+
| 1 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ?mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ?mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ?mol-1)+(-890.3kJ?mol-1)-(-283.0kJ?mol-1)-3×(-285.8kJ?mol-1)=+206.1 kJ?mol-1;
故答案为:+206.1kJ/mol;
点评:本题考查了化学平衡影响因素分析判断,平衡计算分析,主要是恒温恒压、恒温恒容容器中平衡的建立和影响因素的理解应用,题目难度中等.

练习册系列答案
相关题目
铜与人体分泌物中的盐酸以及空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)即是一种弱酸也是一种自由基,具有极高的活性.下列说法或表示正确的是( )
| A、氧化产物是HO2 |
| B、HO2在碱中能稳定存在 |
| C、氧化剂是O2 |
| D、1 mol Cu参加反应有2 mol电子发生转移 |
下列实验操作,正确的是( )
| A、中和滴定时,用标准液润洗滴定管,用待测液润洗锥形瓶,并滴入l mL指示剂 |
| B、配制物质的量浓度溶液时,将称量好的溶质溶于盛有适量水的烧杯中,溶解后立即倾入容量瓶中,继续进行洗涤和定容 |
| C、制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,再缓缓将NaOH溶液挤出 |
| D、溴乙烷和烧碱溶液共热后,将硝酸银溶液滴入水解液中,即可见到淡黄色沉淀 |
下列说法正确的是( )
| A、水泥、玻璃、陶瓷都是硅酸盐产品,均属于无机非金属材料 |
| B、明矾、漂白粉、臭氧都可作净水剂,其净水原理相同 |
| C、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
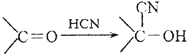
 );
);