题目内容
实验室用固体烧碱配制250mL0.5mol?L-1的NaOH溶液.
(1)需称量 g 烧碱,应放在 中称量.
(2)完成此配制实验,除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有
(3)下述操作中使配制的溶液物质的量浓度偏大的有 (填写字母).
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
(1)需称量
(2)完成此配制实验,除了量筒、烧杯、玻璃棒外还需要的常见的玻璃仪器有
(3)下述操作中使配制的溶液物质的量浓度偏大的有
A.称量时用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
考点:配制一定物质的量浓度的溶液
专题:
分析:(1)根据n=cV、m=nM计算出需要称量的氢氧化钠固体的质量;氢氧化钠容易潮解、具有腐蚀性,应该防止小烧杯中称量;
(2)根据配制250mL 0.5mol?L-1的NaOH溶液的步骤选取仪器;
(3)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)根据配制250mL 0.5mol?L-1的NaOH溶液的步骤选取仪器;
(3)根据c=
| n |
| V |
解答:
解:(1)需要称取的氢氧化钠的质量为:m=cVM=0.5mol/L×0.25L×40g/mol=5.0g,烧碱易吸水且具有强腐蚀性,所以称量烧碱时要放在烧杯中,
故答案为:5.0;小烧杯;
(2)配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,用烧杯溶解烧碱、可以用量筒量取水、用玻璃棒搅拌和引流、用250mL的容量瓶配制溶液、用胶头滴管定容、用托盘天平称量烧碱、用药匙取药品,所以不会用到的仪器有:250mL容量瓶,胶头滴管,
故答案为:250mL容量瓶,胶头滴管;
(3)A.砝码生锈后质量偏大,称量时m物=m砝+m游,称量时用了生锈的砝码后会导致溶质的质量偏大,故浓度偏大,故A选;
B.氢氧化钠易潮解,故将NaOH放在纸张上称量会导致真正的氢氧化钠的质量偏小,则浓度偏小,故B不选;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,则冷却后溶液体积偏小,浓度偏大,故C选;
D.往容量瓶转移时,有少量液体溅出,会导致溶质损失,浓度偏小,故D不选;
E.未洗涤溶解NaOH的烧杯,会导致溶质损失,浓度偏小,故E不选;
F.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故F不选;
G.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故G不选;
H.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线是正常的,再加水至刻度线会导致浓度偏小,故H选.
故选ACF.
故答案为:5.0;小烧杯;
(2)配制溶液的步骤是:称量、溶解、冷却、转移、洗涤、转移、定容、摇匀,用烧杯溶解烧碱、可以用量筒量取水、用玻璃棒搅拌和引流、用250mL的容量瓶配制溶液、用胶头滴管定容、用托盘天平称量烧碱、用药匙取药品,所以不会用到的仪器有:250mL容量瓶,胶头滴管,
故答案为:250mL容量瓶,胶头滴管;
(3)A.砝码生锈后质量偏大,称量时m物=m砝+m游,称量时用了生锈的砝码后会导致溶质的质量偏大,故浓度偏大,故A选;
B.氢氧化钠易潮解,故将NaOH放在纸张上称量会导致真正的氢氧化钠的质量偏小,则浓度偏小,故B不选;
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,则冷却后溶液体积偏小,浓度偏大,故C选;
D.往容量瓶转移时,有少量液体溅出,会导致溶质损失,浓度偏小,故D不选;
E.未洗涤溶解NaOH的烧杯,会导致溶质损失,浓度偏小,故E不选;
F.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏大,故F不选;
G.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故G不选;
H.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线是正常的,再加水至刻度线会导致浓度偏小,故H选.
故选ACF.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
在一定条件下,在密闭容器中发生合成氨反应,N2、H2、NH3的起始浓度分别为c1、c2、c3(均不为0).当反应达到平衡时,它们的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1.下列判断错误的是( )
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |
下列图示与对应的叙述相符的是( )
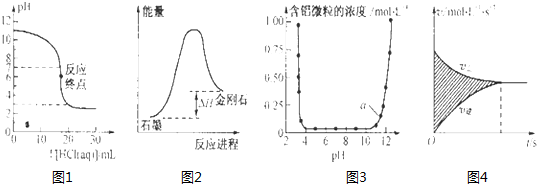

| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |
常温下,关于下列各溶液的叙述正确的是( )
| A、pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B、0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C、0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D、已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
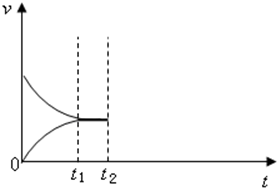 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.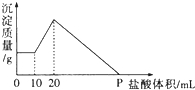 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求: