题目内容
对于C(s)+CO2(g)═2CO(g)的反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志. (判断对错)
考点:化学平衡状态的判断
专题:化学平衡专题
分析:化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,结合反应的特点进行分析.
解答:
解:反应前后气体的质量不等,在恒温恒容条件下,混合气体的密度逐渐增大,当达到平衡状态时,容器中混合气体的密度不变;
而恒温恒压条件下,随反应进行,体系的体积增大,分子量:CO2>CO,故混合气体的密度逐渐减小,当密度保持不变,反应达到平衡,
故答案为:√.
而恒温恒压条件下,随反应进行,体系的体积增大,分子量:CO2>CO,故混合气体的密度逐渐减小,当密度保持不变,反应达到平衡,
故答案为:√.
点评:本题考查化学平衡状态的判断,题目难度不大,本题注意把握判断是否达到平衡的角度,解答该类题目一定要分析反应的特点,特别是反应前后气体的变化关系以及有无固体参加反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子一定能在常温指定环境中大量共存的是( )
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
下列有水参与或生成的反应不属于取代反应的是( )
| A、CH2═CH2+H2O→CH3CH2OH | |||
B、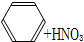
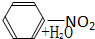 | |||
C、CH3COOH+HOCH2CH3
| |||
D、CH3CH2Cl+H2O
|
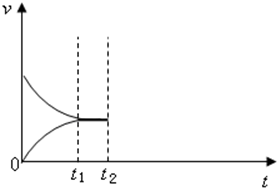 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.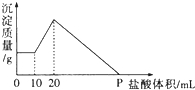 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求: