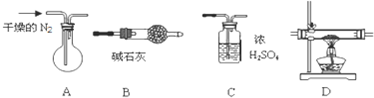
题目内容
被称为“第三金属”的钛在现代科学技术上有着广泛的用途,例如用于制飞机的发动机、坦克、军舰等.工业上常用钛铁矿(主要成分是FeTiO3,含少量Fe2O3、SiO2等杂质)为原料来制取金属钛.工艺流程如下:
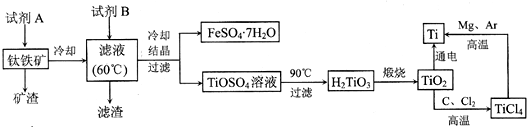
已知:2H2SO4+FeTiO3═TiOSO4+FeSO4+2H2O
TiOSO4+2H2O
H2TiO3↓+H2SO4
回答下列问题:
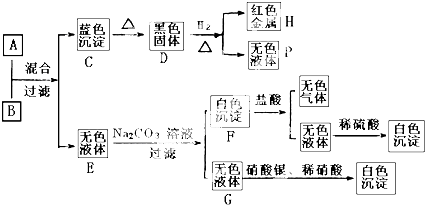
(1)试剂A的名称是 ,矿渣的成分是 (填化学式0.
(2)向滤液中加入试剂B时发生化学反应的离子方程式是 .
(3)从TiOSO4溶液制H2TiO3需要加热的目的是 .
(4)滤液需冷却至60℃左右,若温度过高会导致产品钛的收率降低,原因是 .
(5)写出在氩气保护下,有TiCl4制Ti的化学方程式 .
(6)点解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解波,用碳块作电解槽池,其阴极反应的电极反应式是 .
(7)通常TiO2(s)+2Cl2(g)?TiCl4(I)+O2(g)△H=+151KJ/mol反应难以发生,工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入炭后,上述反应就能顺利进行,其原因是 .

已知:2H2SO4+FeTiO3═TiOSO4+FeSO4+2H2O
TiOSO4+2H2O
| ||
回答下列问题:
(1)试剂A的名称是
(2)向滤液中加入试剂B时发生化学反应的离子方程式是
(3)从TiOSO4溶液制H2TiO3需要加热的目的是
(4)滤液需冷却至60℃左右,若温度过高会导致产品钛的收率降低,原因是
(5)写出在氩气保护下,有TiCl4制Ti的化学方程式
(6)点解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解波,用碳块作电解槽池,其阴极反应的电极反应式是
(7)通常TiO2(s)+2Cl2(g)?TiCl4(I)+O2(g)△H=+151KJ/mol反应难以发生,工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入炭后,上述反应就能顺利进行,其原因是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:制取金属钛其生产流程为:钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]加过量硫酸,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O,Fe2O3溶于过量硫酸,生成Fe3+离子,SiO2杂质不溶于酸,过滤滤渣为SiO2杂质,滤液为Fe2+、TiO2+、Fe3+,加入铁粉,发生了反应:2Fe3++Fe═3Fe2+,冷却过滤得绿矾和TiO2+、SO42-,TiO2+在加热条件下与水反应TiOSO4+2H2O
H2TiO3↓+H2SO4
生成H2TiO3,煅烧得到TiO2,电解得到Ti,TiO2+Cl2+2C
TiCl4+2CO,TiCl4+2Mg
2MgCl2+Ti,得到Ti.
(1)根据题干信息,2H2SO4+FeTiO3═TiOSO4+FeSO4+2H2O选择硫酸为试剂A,根据杂质的性质和硫酸的性质分析矿渣的成分;
(2)由工艺流程转化关系可知,加入试剂B可将Fe3+转化为亚铁离子;
(3)根据TiOSO4的水解平衡的影响因素知识来回答;
(4)由于TiOSO4容易水解,若温度过高,会导致TiOSO4提前水解,则会有较多TiOSO4水解为固体H2TiO3,钛元素损失;
(5)镁与四氯化钛在高温下发生置换反应生成氯化镁和金属钛;
(6)根据电解原理:阴极上是发生得电子的还原反应;
(7)从平衡移动的原理:减少生成物的浓度,化学平衡向着正反应方向移动;
| ||
生成H2TiO3,煅烧得到TiO2,电解得到Ti,TiO2+Cl2+2C
| ||
| ||
| 高温 |
(1)根据题干信息,2H2SO4+FeTiO3═TiOSO4+FeSO4+2H2O选择硫酸为试剂A,根据杂质的性质和硫酸的性质分析矿渣的成分;
(2)由工艺流程转化关系可知,加入试剂B可将Fe3+转化为亚铁离子;
(3)根据TiOSO4的水解平衡的影响因素知识来回答;
(4)由于TiOSO4容易水解,若温度过高,会导致TiOSO4提前水解,则会有较多TiOSO4水解为固体H2TiO3,钛元素损失;
(5)镁与四氯化钛在高温下发生置换反应生成氯化镁和金属钛;
(6)根据电解原理:阴极上是发生得电子的还原反应;
(7)从平衡移动的原理:减少生成物的浓度,化学平衡向着正反应方向移动;
解答:
解:(1)钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]加过量硫酸,FeTiO3溶于过量硫酸,2H2SO4+FeTiO3═TiOSO4+FeSO4+2H2O,生成Fe2+、TiO2+、H2O,Fe2O3溶于过量硫酸,生成Fe3+离子,SiO2杂质不溶于酸,过滤滤渣为SiO2杂质,滤液为Fe2+、TiO2+、Fe3+,
故答案为:硫酸;SiO2;
(2)经硫酸溶解后得到的Fe2(SO4)3,而后面过滤得到的是FeSO4?7H2O,所以试剂B是铁粉,把Fe3+还原为Fe2+,2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)从 TiOSO4→H2TiO3是物质水解的过程,加热能够促进水解的进行,
故答案为:促进TiOSO4的水解;
(4)由于TiOSO4容易水解,若温度过高,会导致TiOSO4提前水解,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4?7H2O中导致TiO2产率降低,钛元素损失,
故答案为:温度过高,会导致TiOSO4提前水解,钛元素损失;
(5)二氧化钛中,氧元素的化合价为-2价,因此钛元素的化合价为+4价;镁与四氯化钛在高温下反应生成氯化镁和金属钛TiCl4+2Mg
2MgCl2+Ti,
故答案为:TiCl4+2Mg
2MgCl2+Ti;
(6)因TiO2作阴极,得到电子,被还原,TiO2 +4e-=Ti+2O2-,得到单质Ti,
故答案为:TiO2 +4e-=Ti+2O2-;
(7)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)碳单质与氧气反应,因减少生成物的浓度,平衡正向移动,导致反应顺利进行,
故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行;
故答案为:硫酸;SiO2;
(2)经硫酸溶解后得到的Fe2(SO4)3,而后面过滤得到的是FeSO4?7H2O,所以试剂B是铁粉,把Fe3+还原为Fe2+,2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)从 TiOSO4→H2TiO3是物质水解的过程,加热能够促进水解的进行,
故答案为:促进TiOSO4的水解;
(4)由于TiOSO4容易水解,若温度过高,会导致TiOSO4提前水解,则会有较多TiOSO4水解为固体H2TiO3而经过滤进入FeSO4?7H2O中导致TiO2产率降低,钛元素损失,
故答案为:温度过高,会导致TiOSO4提前水解,钛元素损失;
(5)二氧化钛中,氧元素的化合价为-2价,因此钛元素的化合价为+4价;镁与四氯化钛在高温下反应生成氯化镁和金属钛TiCl4+2Mg
| ||
| 高温 |
故答案为:TiCl4+2Mg
| ||
| 高温 |
(6)因TiO2作阴极,得到电子,被还原,TiO2 +4e-=Ti+2O2-,得到单质Ti,
故答案为:TiO2 +4e-=Ti+2O2-;
(7)TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)碳单质与氧气反应,因减少生成物的浓度,平衡正向移动,导致反应顺利进行,
故答案为:碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行;
点评:本题考查学生对工艺流程理解、阅读题目获取信息能力、化学平衡的移动原理、氧化还原反应及方程式的书写等,难度中等,理解工艺流程是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力.

练习册系列答案
相关题目
一定条件下,在体积为3L的密闭容器中,发生反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下甲醇的物质的量随时间的变化如图所示,下列叙述真确的是( )
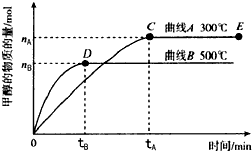

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
下列图示与对应的叙述相符的是( )
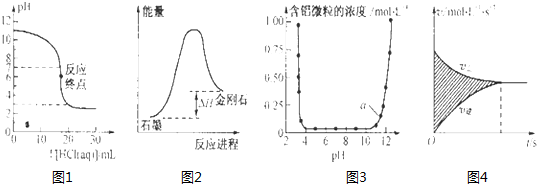

| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |

 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.