题目内容
铜与人体分泌物中的盐酸以及空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)即是一种弱酸也是一种自由基,具有极高的活性.下列说法或表示正确的是( )
| A、氧化产物是HO2 |
| B、HO2在碱中能稳定存在 |
| C、氧化剂是O2 |
| D、1 mol Cu参加反应有2 mol电子发生转移 |
考点:氧化还原反应
专题:
分析:Cu+HCl+O2=CuCl+HO2中,Cu元素的化合价升高,O元素的化合价降低降低,以此来解答.
解答:
解:A.O元素得到电子被还原,则还原产物是HO2,故A错误;
B.HO2(超氧酸)是一种弱酸,可与碱发生中和反应,则不能在碱中能稳定存在,故B错误;
C.O元素的化合价降低,则氧化剂是O2,故C正确;
D.Cu元素的化合价由0升高为+1价,则1molCu参加反应有1mol电子发生转移,故D错误.
故选C.
B.HO2(超氧酸)是一种弱酸,可与碱发生中和反应,则不能在碱中能稳定存在,故B错误;
C.O元素的化合价降低,则氧化剂是O2,故C正确;
D.Cu元素的化合价由0升高为+1价,则1molCu参加反应有1mol电子发生转移,故D错误.
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意信息的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组离子一定能在常温指定环境中大量共存的是( )
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
若要在铜片上镀银时,下列叙述中错误的是:①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是 Ag++e-=Ag④在银片上发生的反应是4OH--4e-=2H2O+O2↑ ⑤可用硫酸铜溶液作电解质溶液( )
| A、①③④ | B、②③⑤ |
| C、①④⑤ | D、②④⑤ |
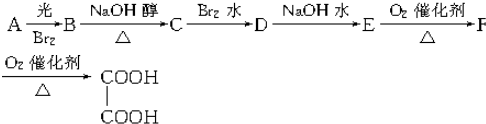
下列有水参与或生成的反应不属于取代反应的是( )
| A、CH2═CH2+H2O→CH3CH2OH | |||
B、
 | |||
C、CH3COOH+HOCH2CH3
| |||
D、CH3CH2Cl+H2O
|

 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.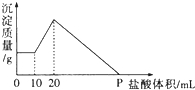 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:求: