题目内容
某同学设计了以下操作流程来除去混在氯化钠固体中的少量硫酸钠和氯化钙.

(1)试剂A是 .
(2)操作a得到的滤渣的成分是 ,在实验室中进行操作a需要的仪器是:铁架台(带铁圈)、滤纸、烧杯、 .
(3)加入试剂C调节滤液pH的离子反应方程式是 .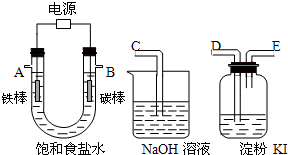
(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性,部分装置如图:
①碳棒接直流电源的 极; 铁棒上发生的电极反应为 .
②说明氯气具有氧化性的实验现象是 .
③将上图中的仪器,连成一整套装置,各种仪器接口的连接顺是B接 , 接 .

(1)试剂A是
(2)操作a得到的滤渣的成分是
(3)加入试剂C调节滤液pH的离子反应方程式是

(4)该同学想利用上述得到的氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性,部分装置如图:
①碳棒接直流电源的
②说明氯气具有氧化性的实验现象是
③将上图中的仪器,连成一整套装置,各种仪器接口的连接顺是B接
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:
分析:氯化钠固体中的少量硫酸钠和氯化钙加水溶解,加氯化钡(A)除去硫酸根离子,在加过量的碳酸钠(B)除去多余的钡离子,过滤去除沉淀,加盐酸调节pH,除去多余的碳酸根离子,得到氯化钠溶液,蒸发结晶得到氯化钠晶体;
(1)欲除去溶液I中的CaCl2、Na2SO4,则用氯化钡除掉硫酸钠;
(2)根据化学反应及物质的溶解性分析沉淀的物质;根据过滤操作确定仪器;
(3)在滤液中加盐酸的作用,应考虑除去Na2CO3溶液;
(4)①根据电解饱和食盐水的原理可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子放电,阴极上阳离子放电,以此来解答.
②检验氯气的氧化性,应选择还原性物质,且反应现象明显;
③根据电解饱和食盐水的原理可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子放电产生氯气,阴极上阳离子放电产生氢气,以此来解答.
(1)欲除去溶液I中的CaCl2、Na2SO4,则用氯化钡除掉硫酸钠;
(2)根据化学反应及物质的溶解性分析沉淀的物质;根据过滤操作确定仪器;
(3)在滤液中加盐酸的作用,应考虑除去Na2CO3溶液;
(4)①根据电解饱和食盐水的原理可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子放电,阴极上阳离子放电,以此来解答.
②检验氯气的氧化性,应选择还原性物质,且反应现象明显;
③根据电解饱和食盐水的原理可知,碳为阳极,Fe为阴极,电解饱和食盐水,阳极上阴离子放电产生氯气,阴极上阳离子放电产生氢气,以此来解答.
解答:
解:氯化钠固体中的少量硫酸钠和氯化钙加水溶解,加氯化钡(A)除去硫酸根离子,在加过量的碳酸钠(B)除去多余的钡离子,过滤去除沉淀,加盐酸调节pH,除去多余的碳酸根离子,得到氯化钠溶液,蒸发结晶得到氯化钠晶体;
(1)欲除去溶液I中的CaCl2、Na2SO4,则用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
故答案为:BaCl2;
(2)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀,碳酸钠和氯化钡反应生成碳酸钡沉淀,故过滤后得到的沉淀成分有碳酸钡、硫酸钡、碳酸钙;
过滤操作需要仪器铁架台(带铁圈)、滤纸、烧杯、漏斗、玻璃棒,
故答案为:碳酸钡、硫酸钡、碳酸钙;漏斗、玻璃棒;
(3)在滤液中加盐酸可以跟氢氧化钠和过量的碳酸钠反应,离子方程式为:CO32-+2H+═H2O+CO2↑,
故答案为:CO32-+2H+═H2O+CO2↑;
(4)①碳与电源的正极相连,则为阳极,所以Fe为阴极,电解饱和食盐水,阴极上发生:2H++2e?→H2↑,
故答案为:正;2H++2e?=H2↑;
②氯气氧化碘化钾,生成碘单质,碘单质遇淀粉溶液变蓝色,
故答案为:KI淀粉溶液变蓝;
③碳棒上阴离子放电产生氯气,Fe棒上阳离子放电产生氢气,所以B端是检验氯气的氧化性,连接D,然后再进行尾气吸收,E接C,
故答案为:D;E;C.
(1)欲除去溶液I中的CaCl2、Na2SO4,则用氯化钡除掉硫酸钠,用碳酸钠除掉氯化钙与多余的氯化钡;
故答案为:BaCl2;
(2)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀,碳酸钠和氯化钡反应生成碳酸钡沉淀,故过滤后得到的沉淀成分有碳酸钡、硫酸钡、碳酸钙;
过滤操作需要仪器铁架台(带铁圈)、滤纸、烧杯、漏斗、玻璃棒,
故答案为:碳酸钡、硫酸钡、碳酸钙;漏斗、玻璃棒;
(3)在滤液中加盐酸可以跟氢氧化钠和过量的碳酸钠反应,离子方程式为:CO32-+2H+═H2O+CO2↑,
故答案为:CO32-+2H+═H2O+CO2↑;
(4)①碳与电源的正极相连,则为阳极,所以Fe为阴极,电解饱和食盐水,阴极上发生:2H++2e?→H2↑,
故答案为:正;2H++2e?=H2↑;
②氯气氧化碘化钾,生成碘单质,碘单质遇淀粉溶液变蓝色,
故答案为:KI淀粉溶液变蓝;
③碳棒上阴离子放电产生氯气,Fe棒上阳离子放电产生氢气,所以B端是检验氯气的氧化性,连接D,然后再进行尾气吸收,E接C,
故答案为:D;E;C.
点评:本题主要考查了粗盐的提纯、电解饱和食盐水,掌握实验的原理是解题的关键,题目难度中等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
在一定条件下,在密闭容器中发生合成氨反应,N2、H2、NH3的起始浓度分别为c1、c2、c3(均不为0).当反应达到平衡时,它们的浓度分别为0.1mol?L-1、0.3mol?L-1、0.08mol?L-1.下列判断错误的是( )
| A、当H2与NH3生成速率为3:2时,反应一定达到平衡状态 |
| B、H2与N2的转化率一定相等 |
| C、c1一定等于0.14mol?L-1 |
| D、c3的取值范围为:0<c3<0.28mol?L-1 |
下列各组离子一定能在常温指定环境中大量共存的是( )
| A、在c(H+)=10-10mol?L-1的溶液中:Al3+、NH4+、Cl-、NO3- |
| B、pH值为1的溶液:Fe2+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12 mol?L-1的溶液:K+、HCO3-、Cl-、ClO- |
| D、pH值为13的溶液:K+、CO32-、Na+、S2- |
 甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.
甲是容积可变的容器,乙是容积固定为2L的密闭容器,分别向甲、乙两容器中均充入N20.6mol,H20.5mol,在一定温度下进行N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol反应,t1时达到平衡,甲容器中N2的转化率为1/6,体积为1L.