题目内容
4.对“AgCl(s)?Ag+(aq)+Cl-(aq)”的理解正确的是( )①说明AgCl没有完全电离,AgCl是弱电解质
②说明溶解的AgCl已完全电离,是强电解质
③说明Cl-与Ag+的反应不能完全进行到底
④说明Cl-与Ag+的反应可以完全进行到底.
| A. | ③④ | B. | ③ | C. | ①③ | D. | ②④ |
分析 氯化银悬浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq),即沉淀电离为离子的速率与离子结合成沉淀的速率相等,该过程为可逆过程,据此进行解答.
解答 解:①AgCl(s)?Ag+(aq)+Cl-(aq)为AgCl的沉淀溶解平衡,不是电离方程式,AgCl在熔融状态下完全电离,为强电解质,故①错误;
②该反应为AgCl的沉淀溶解平衡,不是电离方程式,根据该平衡不能判断AgCl为强电解质,故②错误;
③AgCl(s)?Ag+(aq)+Cl-(aq)为可逆反应,说明Cl-与Ag+的反应不能完全进行到底,故③正确;
④AgCl(s)?Ag+(aq)+Cl-(aq)为可逆过程,所以Ag+与Cl-的反应不能完全进行到底,故④错误;
故选B.
点评 本题考查了沉淀溶解平衡的应用,题目难度不大,注意对沉淀溶解平衡方程式的理解,明确难溶物溶解平衡及其沉淀转化的本质为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
14. 利用所学知识回答下列问题
利用所学知识回答下列问题
Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
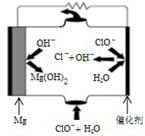
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
(4)室温下,0.1mol/L Na2CO3溶液的pH>0.1mol/LNa2SO3溶液的pH(选填“>”、“<”或“=”).
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
 利用所学知识回答下列问题
利用所学知识回答下列问题Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
15.下列有关说法正确的是( )
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
19.在一定温度和压强下,气体体积主要取决于( )
| A. | 气体分子数目的多少 | B. | 气体分子微粒大小 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子量的大小 |
9.下列说法正确的是( )
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |