题目内容
14. 利用所学知识回答下列问题
利用所学知识回答下列问题Ⅰ.(1)已知室温下,Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液的pH=10.
(2)向1mL0.1mol/LMgCl2溶液中滴加2滴2mol/LNaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,结果有红褐色沉淀出现.请写出红褐色沉淀生成时的离子方程式3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3.
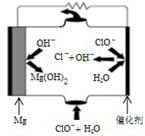
(3)“镁-次氯酸盐”燃料电池的工作原理如图所示,根据图写出镁电极的电极反应式Mg-2e-+2OH-=Mg(OH)2.
Ⅱ.室温下,两种酸的电离平衡常数如下表.
| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
(5)0.10mol/L Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
分析 (1)根据氢氧化镁的溶度积计算出氢氧根离子浓度,然后计算出该溶液的氢离子浓度及溶液的pH;
(2)MgCl2与NaOH反应生成氢氧化镁沉淀,Fe(OH)3比Mg(OH)2更难溶,沉淀向着更难溶的物质转化;
(3)该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,在碱性环境中负极电极反应式为Mg-2e-+2OH-=Mg(OH)2,正极电极反应式为:ClO-+H2O+2e-=Cl-+2OH-;
(4)两溶液水解都呈碱性,盐的水解沉淀越大,溶液的pH越大,结合酸根离子对应酸的酸性强弱判断;
(5)Na2SO3溶液中,亚硫酸根离子部分水解,溶液呈碱性,则c (OH-)>c(H+),结合氢氧根离子来自水的电离和亚硫酸根离子的水解可知c (OH-)>c(HSO3-),据此判断各离子浓度大小.
解答 解:(1)已知室温下Ksp[Mg(OH)2]=5×10-12,若溶液中c(Mg2+)=5×10-4 mol/L,则溶液中的氢氧根离子浓度为:c(OH-)=$\sqrt{\frac{5×1{0}^{-12}}{5×1{0}^{-4}}}$mol/L=1×10-4 mol/L,则溶液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-4}}$mol/L=1×10-10 mol/L,该溶液得到pH=10,
故答案为:10;
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,MgCl2与NaOH反应生成氢氧化镁沉淀,其反应的离子方程式为:Mg2++2OH-═Mg(OH)2↓;再滴加2滴0.1mol/L FeCl3溶液,Mg(OH)2沉淀转化为溶解度更小的Fe(OH)3沉淀,其反应的离子方程式为:3Mg(OH)2+2Fe3+?3Mg2++2Fe(OH)3,
故答案为:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3;
(3)根据图示可知,该燃料电池中,镁易失电子作负极、次氯酸根离子得电子发生还原反应,则负极电极反应式为:Mg-2e-+2OH-=Mg(OH)2,
故答案为:Mg-2e-+2OH-=Mg(OH)2;
(4)相同条件下酸性:HSO3->HCO3-,则室温下碳酸钠的水解程度对应亚硫酸钠,则0.1mol/L Na2CO3溶液的pH>0.1mol/LNa2SO3溶液的pH,
故答案为:>;
(5)由于亚硫酸根离子部分水解,溶液呈碱性,则c (OH-)>c(H+),结合氢氧根离子来自水的电离和亚硫酸根离子的水解可知:c (OH-)>c(HSO3-),溶液中离子浓度大小为:c(Na+)>c (SO32-)>c (OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c (SO32-)>c (OH-)>c(HSO3-)>c(H+).
点评 本题考查较为综合,涉及原电池原理、难溶物溶解平衡、离子浓度大小比较等知识,题目难度中等,注意掌握难溶物溶度积的概念及表达式,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.

| A. | 马口铁(镀锡铁)镀层破损铁的腐蚀速率加快 | |
| B. | 为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极 | |
| C. | 可以采用改变金属组成或结构的方法防止金属腐蚀 | |
| D. | 为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块 |
(1)已知:2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol
2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol
SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol
写出由H2S气体一步合成硫酸的热化学方程式H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol.
(2)硫化氢气体会污染空气,可用CuSO4溶液除去,写出该离子方程式Cu2++H2S═CuS↓+2H+.除去含Cu2+的废水能(填“能”或“不能”)用FeS作沉淀剂.
[已知Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36)]
(3)t℃,在一密闭容器中发生如下反应 2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,在不同时间测得H2S和SO2的浓度如下表所示:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(H2S)/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c(SO2)/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
②2~8分钟SO2的平均反应速率为0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min).
③t℃时,该反应的平衡常数为8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3.
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 氯化银、溴化银和碘化银的溶解度依次增大 | |
| B. | 将硫酸银溶解于水后,向其中加入少量硫化钠固体,不能得到黑色沉淀 | |
| C. | 在5mL1.5×10-5 mol•L-1的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol•L-1的AgNO3溶液,不能观察到白色沉淀 | |
| D. | 在烧杯中放入6.24 g 硫酸银固体,加200 g 水,经充分溶解后,所得饱和溶液的体积为200 mL,溶液中Ag+ 的物质的量浓度为0.2 mol•L-1 |
| A. | c(Ag+) | B. | $\frac{c(C{l}^{-})}{c(B{r}^{-})}$ | C. | c(Cl-) | D. | $\frac{c(A{g}^{+})•c(B{r}^{-})}{c(C{l}^{-})}$ |
 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验: 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题: