题目内容
13.在一定条件,将充满NO2和O2的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体的$\frac{1}{8}$,原混合气体中NO2和O2的体积比是( )①8:1 ②7:3 ③7:1 ④4:1.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 NO2和O2的混合气体通入倒立于水槽中盛满水的试管中,发生反应可能为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,剩余气体的体积为原混合气体的$\frac{1}{8}$,试管中剩余$\frac{1}{8}$体积的可能为NO或O2,结合反应方程式列式计算.
解答 解:发生反应为:4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO,
剩余气体的体积为原混合气体的$\frac{1}{8}$,则试管中剩余$\frac{1}{8}$体积的为NO或O2,
设NO2和O2的总体积为V,
当剩余气体为NO时,说明氧气不足,生成$\frac{1}{8}$V体积的NO消耗二氧化氮的体积为:$\frac{1}{8}$V×3=$\frac{3}{8}$V,
则反应4NO2+O2+2H2O=4HNO3中总共消耗二氧化氮和氧气的总体积为:$\frac{5}{8}$V,原混合气体中氧气的体积为:$\frac{5}{8}$V×$\frac{1}{5}$=$\frac{1}{8}$V,原混合气体中二氧化氮的体积为:$\frac{7}{8}$V,原混合气体中NO2和O2的体积比为:$\frac{7}{8}$V:$\frac{1}{8}$V=7:1;
当氧气过量时,剩余的$\frac{1}{8}$V体积为氧气,说明二氧化氮不足,则参加反应4NO2+O2+2H2O=4HNO3中总共消耗二氧化氮和氧气的总体积为$\frac{7}{8}$V,混合气体中二氧化氮的总体积为:$\frac{7}{8}$V×$\frac{4}{5}$=$\frac{7}{10}$V,氧气总体积为:$\frac{3}{10}$V,原混合气体中NO2和O2的体积比为:$\frac{7}{10}$V:$\frac{3}{10}$V=7:3,
所以NO2和O2的体积比7:3或7:1,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,题目难度中等,把握发生的化学反应及差量法计算为解答的关键,注意氧气不足量的计算.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案①说明AgCl没有完全电离,AgCl是弱电解质
②说明溶解的AgCl已完全电离,是强电解质
③说明Cl-与Ag+的反应不能完全进行到底
④说明Cl-与Ag+的反应可以完全进行到底.
| A. | ③④ | B. | ③ | C. | ①③ | D. | ②④ |
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
| A. | 27g Al3+所含离子数为3NA | |
| B. | 11.2L氢气完全燃烧转移的电子数目为NA | |
| C. | 常温常压下32g氧气所含的原子数目为2NA | |
| D. | 标准状况下,22.4 L水中含有的水分子数为NA |
| A. | AlCl3═Al3++Cl- | B. | Ca(OH)2═Ca2++(OH)2- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═Na2++SO42- |
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HC1O | H2CO3 |
| KSp 或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10 -5 | Ka=3.0×10-8 | Ka1=4.1×10一7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的关系有:c(Na+)>c(CO32- )>c(CH3COO- ) | |
| B. | 向0.1 mol•L-1 CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时 c(CH3COOH):c(CH3COO-)=9:5 | |
| C. | 少量碳酸氢钠固体加入到新制的氯水中,c(HC1O)增大 | |
| D. | 向浓度均为1×10-3 mol•L-1的KC1和K2CrO4混合液中滴加1×10-3 mol•L-1 的AgNO3溶液,CrO42-先形成沉淀 |
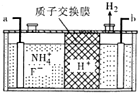 氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题:
氮、磷及其化合物在生产、生活中有重要的用途.回答下列问题: