题目内容
6.氧化还原反应中除了原子守恒(质量守恒)外,氧化剂得电子总数和还原剂失电子总数相等,在一定条件下,RO3n-和I-发生反应的离子方程式为:RO3n-+6I-+6H+═R-+3I2+3H2O(R为主族元素)则:(1)RO3n-中R的化合价为+5价,在周期表的第ⅤⅡA族.
(2)关于物质①K20;②CO2;③NH4Cl;④H2O2;⑤Na2O2;⑥NaOH,请回答下列问题:仅含极性键和非极性键的化合物是④;含有非极性键的离子化合物是⑤.
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时,其负极方程式(写离子方程式)为CH3OH+8OH--6e-=CO32-+6H2O;
(4)一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH+H2O→CH3COOH+4H++4e-,电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O.
分析 (1)根据离子方程式遵循电荷守恒判断RO3n-离子所带电荷,判断化合价;根据生成R-离子可知R得1个电子后达到8电子稳定结构,最外层电子数等于族序数;
(2)由不同非金属元素形成的化学键为极性键;由同种非金属元素形成的化学键为非极性键;离子化合物中一定含有离子键、可能含有共价键,共价化合物中只含共价键;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子;
(4)酸性燃料电池中氧气在正极得电子生成水,根据正极和负极的电极反应式书写总反应.
解答 解:(1)根据离子方程式遵循电荷守恒可知:(-n)+(-6)+6=-1,可知n=1,根据RO3n-离子化合价代数和关系:(x-2×3)=-1(设R的化合价为x),可知x=+5,RO3n-中R元素的化合价不一定为最高正价,应根据反应物中R-离子的化合价进行判断,根据生成R-离子可知R得1个电子后达到8电子稳定结构,应为第ⅤⅡA族元素,最外层电子数为7,故答案为:+5;第ⅤⅡA;
(2)①K2O中含有离子键,是离子化合物;
②CO2 只含有极性共价键,是共价化合物;
③NH4Cl中含有离子键和极性共价键,是离子化合物;
④H2O2含有极性共价键和非极性共价键,是共价化合物;
⑤Na2O2含有离子键和非极性共价键,是离子化合物;
⑥NaOH含有离子键和极性共价键,是离子化合物;
故答案为:④;⑤;
(3)碱性条件下,负极上甲醇失电子生成碳酸根离子,则其电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(4)酸性燃料电池中氧气在正极得电子生成水,其电极反应式为:O2+4H++4e-=2H2O,正极的电极反应式与和负极的电极反应式相加即是总反应,所以电池反应的总方程式为:CH3CH2OH+O2=CH3COOH+H2O,故答案为:CH3CH2OH+O2=CH3COOH+H2O.
点评 本题考查氧化还原反应、化学键、原电池的工作原理,题目难度中等,注意把握电极方程式的书写,特别是电解质溶液的酸碱性.

 阅读快车系列答案
阅读快车系列答案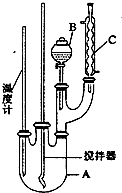 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$ NO2+H2O△H<0
NO2+H2O△H<0反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
| A. | 金属表面的氧化膜都很致密,能对金属起到保护作用 | |
| B. | 金属表面的氧化膜的形成都需要金属暴露在空气中很长时间才会形成 | |
| C. | 金属表面的氧化膜薄层的厚度会随着金属暴露在空气中的时间增长而加厚 | |
| D. | 某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用 |
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 热稳定性:HF>HCl>HBr>HI | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸钠溶液与稀盐酸互滴时,两种操作现象不相同 |
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2.
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
| A. | 用铝丝作高压电缆 | B. | 用不锈钢碗存放食醋 | ||
| C. | 用铝槽车运输浓硫酸 | D. | 用硬铝作制航天器的材料 |
| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |