题目内容
18.化学与我们的生活息息相关.下列说法错误的是( )| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
分析 A.漂白粉的有效成分为次氯酸钙,溶液中次氯酸根离子水解显碱性,可与酸反应生成具有漂白性的次氯酸,促进平衡正向进行,次氯酸浓度增大;
B.二氧化硫有毒,不能用作食品添加剂;
C.铝性质活泼,铝和氧气反应生成氧化铝;
D.氢氧化铝是两性氢氧化物和胃酸反应,治疗胃酸过多,长期服用元素的过量摄入对人体是有害.
解答 解:A.漂白粉溶液中存在水解平衡,ClO-+H2O?HClO+OH-,溶液显碱性,加入少量醋酸中和OH-,促进平衡正向进行,生成次氯酸的浓度增大,会增强漂白效果,故A正确;
B.二氧化硫有毒,不能用作食品添加剂,不能用二氧化硫漂白米粉等,故B正确;
C.铝性质活泼,铝和氧气反应生成氧化铝,在表面生成一层致密的氧化物,能够防止铝的进一步腐蚀,故C错误;
D.氢氧化铝是两性氢氧化物和胃酸反应,治疗胃酸过多,摄铝量增加,从而影响脑细胞功能,导致记忆力下降,思维能力迟钝,故D正确;
故选C.
点评 本题考查较为综合,多角度考查金属的性质以及应用,为高频考点,侧重于双基的考查,注意把握金属的性质及应用,难度不大.

练习册系列答案
相关题目
3.下列离子方程式不正确的是( )
| A. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++3ClO-+SO2+H2O═CaSO4+2HClO+Cl- | |
| B. | 向偏铝酸钠溶液中通入少量的二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向硅酸钠水溶液中通入少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通入少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
10.下列有关阿伏加德罗常数NA的说法正确的是( )
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
7.下列选项表示物质结构的化学用语或模型正确的是( )
| A. | 甲烷分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: | D. | 甲醛的结构式: |
8.硫铁矿(主要成分为FeS2)在空气中高温煅烧可得SO2和Fe2O3,是我国硫酸工业的主要原料.某化学研究小组拟在实验室利用硫铁矿煅烧所得残渣(主要成分为Fe2O3,还含少量的SiO2,Al2O3,其余杂质不参予反应),制取颜料铁红(Fe2O3).设计工艺流程如下: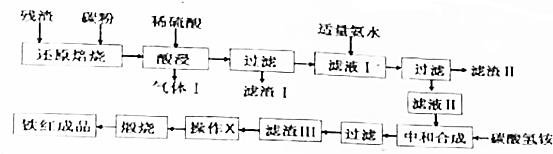
查阅资料:
Ⅰ部分金属离子发生沉淀的pH:
Ⅱ“中和合成”时发生的主要反应为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
请根据以上工艺流程及提供的信息,回答下列问题:
(1)气体Ⅰ的主要成分为H2(填化学式,下同);滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3.
(2)操作X为洗涤(填操作名称).
(3)向滤液Ⅰ中加入适量氨水,其目的是调节溶液的pH到5.4~7.5之间.
(4)在“酸浸”过程中,若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示):4Fe2++O2+4H+═4Fe3++2H2O.
(5)为测定滤液Ⅰ中的Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取20.00mL滤液Ⅰ于锥形瓶中,用0.1mol/L酸性高锰酸钾溶液滴定到终点时消耗了标准酸性高锰酸钾溶液12.00mL,则滤液Ⅰ中c(Fe2+)=0.3mol/L.

查阅资料:
Ⅰ部分金属离子发生沉淀的pH:
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
请根据以上工艺流程及提供的信息,回答下列问题:
(1)气体Ⅰ的主要成分为H2(填化学式,下同);滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3.
(2)操作X为洗涤(填操作名称).
(3)向滤液Ⅰ中加入适量氨水,其目的是调节溶液的pH到5.4~7.5之间.
(4)在“酸浸”过程中,若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示):4Fe2++O2+4H+═4Fe3++2H2O.
(5)为测定滤液Ⅰ中的Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取20.00mL滤液Ⅰ于锥形瓶中,用0.1mol/L酸性高锰酸钾溶液滴定到终点时消耗了标准酸性高锰酸钾溶液12.00mL,则滤液Ⅰ中c(Fe2+)=0.3mol/L.
 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.