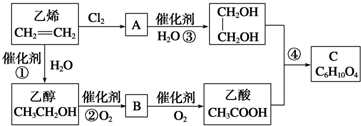
题目内容
16.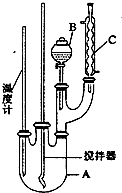 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: +HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50-60℃}^{H_{2}SO_{4}}$ NO2+H2O△H<0
NO2+H2O△H<0反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二销基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
回答下列问题:
(1)图中装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是溶有浓硝酸分解产生的NO2(或硝酸)等杂质.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
分析 (1)装置C为球形冷凝管,起冷凝回流作用;
(2)配制混酸应防止液体迸溅;
(3)反应在50℃~60℃下进行,利用水浴加热控制;溶有浓硝酸分解产生的NO2等杂质;
(4)用氢氧化钠洗去溶解少量酸,水洗除去未反应的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,温差过大容易发生炸裂;
(6)根据苯的质量计算硝基苯的理论产量,产量=(实际产量÷理论产量)×100%.
解答 解:(1)装置C为球形冷凝管,苯与浓硝酸都以挥发,C起冷凝回流作用,提高原料利用率,
故答案为:分液漏斗;冷凝回流;
(2)浓硝酸与浓硫酸混合会放出大量的热,如将浓硝酸加入浓硫酸中,硝酸的密度小于浓硫酸,可能为导致液体迸溅,
故答案为:不能,容易发生迸溅;
(3)反应在50℃~60℃下进行,低于水的沸点,可以利用水浴加热控制,受热均匀,便于控制温度,浓硝酸受热易分解,溶有浓硝酸分解产生的NO2(或硝酸)等杂质而呈黄色,
故答案为:水浴加热;溶有浓硝酸分解产生的NO2(或硝酸)等杂质;
(4)先用水洗除去浓硫酸、硝酸,再用氢氧化钠除去溶解的少量酸,最后水洗除去未反应的NaOH及生成的盐,
故答案为:洗去残留的NaOH及生成的盐;
(5)直形冷凝管通常需要通入冷凝水,以免直形冷凝管通水冷却时导致温差过大而发生炸裂,选用空气冷凝管,不选用直形冷凝管,
故答案为:以免直形冷凝管通水冷却时导致温差过大而发生炸裂;
(6)苯完全反应生成硝基苯的理论产量为15.84g×$\frac{123}{78}$,故硝基苯的产率为[18g÷(15.84g×$\frac{123}{78}$)]×100%=72%,
故答案为:72%.
点评 本题考查有机物制备实验,涉及对装置及操作的分析评价、物质的分离提纯、产率计算等,难度中等,注意操作规范性及仪器作用、渗透安全意识.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | 16 | B. | 32 | C. | 64g/mol | D. | 32g/mol |
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4
②如果将刚取样的上述雨水和自来水相混合,pH将变小(填“大”或“小”),原因是(用化学方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)要测定空气中SO2 的含量,某同学设计如下方案:
将空气以恒定速率x L/min缓慢通入10mL 0.001mol/L酸性高锰酸钾溶液,当一段时间t后通入5m3空气时,溶液恰好褪色(假定空气中其它成分不与酸性高锰酸钾反应).
①写出SO2 与酸性高锰酸钾反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(反应后锰元素以Mn2+ 形式存在).
②SO2 使高锰酸钾溶液褪色体现SO2 的性质是B(填选项)
A.氧化性 B.还原性 C.漂白性 D.酸性氧化物通性
③空气中SO2 的含量为0.32mg/m3
④使溶液褪色所需的时间t越长,则空气中SO2 的含量越小(填“大”或“小”)
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO( g)?N2( g)+2CO2(9)△H=-538kJ/mol
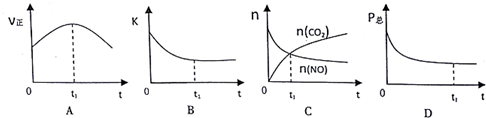
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图
不符合题意的是ABC(填选项序号).(下图中V正、K、n、P总分别表示正反应速率、平衡常
数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(3)如图l所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式N2O4+2HNO3-2e-=2N2O5+2H+.
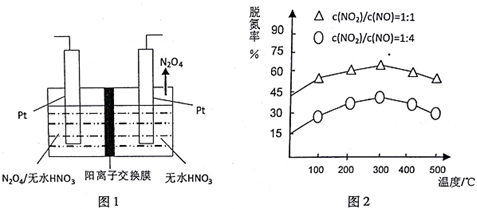
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小,给出合理的解释:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.