题目内容
10.下列环境相同时间内,钢铁能得到有效保护的是( )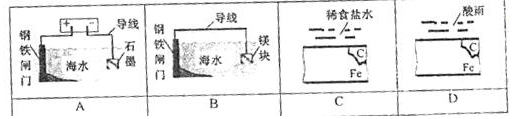
| A. | A | B. | B | C. | C | D. | D |
分析 防止金属被腐蚀,选择牺牲阳极的阴极保护法(原电池)或外加电源的阴极保护法(电解池),且外加电源的阴极保护法比牺牲阳极的阴极保护法更好,以此来解答.
解答 解:A.为电解池,钢铁与电源正极相连,为阳极,失去电子,加快腐蚀,故A不选;
B.构成原电池,Mg为负极,钢铁为正极,为牺牲阳极的阴极保护法,可防止金属腐蚀,故B选;
C.构成原电池,Fe失去电子作负极,发生吸氧腐蚀,加快腐蚀,故C不选;
D.构成原电池,Fe失去电子作负极,发生析氢腐蚀,加快腐蚀,故D不选;
故选B.
点评 本题考查金属的腐蚀与防护,为高频考点,把握电化学装置及工作原理为解答的关键,侧重分析与应用能力的考查,注意常见的金属保护方法,题目难度不大.

练习册系列答案
相关题目
1.根据表中信息,下列叙述正确的是( )
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的热稳定性:H2T<H2R | |
| B. | 单质与稀盐酸反应的速率:L<Q | |
| C. | 离子半径:R2-<L2+ | |
| D. | M与T形成的化合物既能与强酸反应,又能与强碱反应 |
18.下列分离或提纯有机物的方法正确的是( )
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液,洗气 |
| B | 溴苯 | 溴 | NaOH溶液,分液 |
| C | 乙酸 | 乙醇 | 金属钠,蒸馏 |
| D | 乙醇 | 水 | 生石灰,过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.下列图示实验正确的是( )
| A. |  将海带灼烧灰化 | B. |  铝热反应 | ||
| C. |  制取氢氧化亚铁 | D. |  验证铁的吸氧腐蚀 |
15.下列反应的离子方程式正确的是( )
| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O. | |
| B. | 硝酸银溶液和过量的氨水反应:Ag++3NH3•H2O═Ag(NH3)2OH+NH4++2H2O | |
| C. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 碳酸钠溶液中加入过量苯酚: +CO32-→ +CO32-→ +HCO3- +HCO3- |
18.下列叙述错误的是( )
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 地球上99%的溴蕴藏在大海中,故溴被称为“海洋元素” | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 向两等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
19.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:
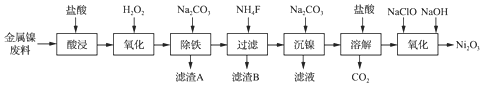
流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末或延长浸泡时间等)等.
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.

流程中相关金属离子生成氢氧化物沉淀的pH如表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(2)加入H2O2时发生主要反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O.
(3)“除铁”时,控制溶液pH的范围为3.2~7.1.
(4)滤渣B的主要成分的化学式为MgF2、CaF2.
(5)已知:Ksp(NiCO3)=1.42×10-7.为确保沉镍完全(即溶液中c(Ni2+)<1.0×10-6),应保持溶液中c(CO32-)>0.142mol•L-1.
(6)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-═Ni2O3↓+Cl-+2H2O.
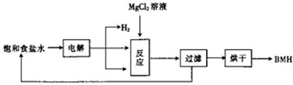 BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.
BMH{碱式次氯酸镁}[Mg2ClO(OH)n•H2O]}是一种白色粉末.难溶于水,是常用的无机抗菌剂,其一种生产工艺如图所示.