题目内容
15.下列反应的离子方程式正确的是( )| A. | 稀硝酸和过量铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O. | |
| B. | 硝酸银溶液和过量的氨水反应:Ag++3NH3•H2O═Ag(NH3)2OH+NH4++2H2O | |
| C. | 向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 碳酸钠溶液中加入过量苯酚: +CO32-→ +CO32-→ +HCO3- +HCO3- |
分析 A.硝酸具有强氧化性,铁具有还原性,铁过量,生成硝酸亚铁;
B.硝酸银溶液和氨水反应,氨水少量生成沉淀,氨水过量沉淀溶解生成络合物[Ag(NH3)2]OH,[Ag(NH3)2]OH易电离出[Ag(NH3)2]+、OH-;
C.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液生成偏铝酸钡、硫酸钡和一水合氨;
D.碳酸的酸性比苯酚强,但苯酚的酸性强于碳酸氢根离子,碳酸钠溶液中加入过量苯酚,生成苯酚钠和碳酸氢钠.
解答 解:A.硝酸具有强氧化性,铁具有还原性,硝酸过量,铁被氧化成+3价,Fe+4HNO3 =Fe(NO3)3+NO↑+2H2O;铁过量,过量的铁与产物硝酸铁反应,生成硝酸亚铁3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,总离子方程式为3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故A错误;
B.硝酸银中滴氨水是银氨溶液的配制,先产生白色氢氧化银沉淀,继续滴加,形成配合物银氨络离子(银氨溶液)使沉淀溶解.先发生:Ag ++NH3•H2O=AgOH↓+NH4+,后发生:AgOH+2NH3•H2O=[Ag(NH3)2]++OH-+2H2O,总反应为:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O,故B错误;
C.向NH4Al(SO4)2溶液中加入过量的Ba(OH)2溶液,氢氧根过量,铝离子生成偏铝酸根离子,铵根离子生成一水合氨,离子方程式:2Ba2++NH4++Al3++2SO42-+5OH-═AlO2-+2BaSO4↓+NH3•H2O+2H2O,故C错误;
D.苯酚和碳酸钠反应生成碳酸氢钠和苯酚钠,C6H5OH+Na2CO3→C6H6ONa+NaHCO3,离子反应为 +CO32-→
+CO32-→ +HCO3-,故D正确;
+HCO3-,故D正确;
故选D.
点评 本题考查离子方程式的书写,题目难度中等,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析,D为易错点,碳酸的酸性比苯酚强,但苯酚的酸性强于碳酸氢根离子.

| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
(1)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成,反应中,生成3mol H2时放出30.8KJ的热.
①反应的热化学方程式是2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H=-30.8KJ/mol.
②反应的化学平衡常数表达式是$\frac{{c}^{3}({H}_{2})}{{c}^{2}(N{H}_{3})}$;温度升高时,反应的平衡常数变小.(填“变大”“变小”或“不变”)
③在密闭体系内进行上述可逆反应,下列有关表达正确的是A.

A.图象Ⅰ中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B.图象Ⅱ中纵坐标可以为镓的转化率
C.图象Ⅲ中纵坐标可以为化学反应速率
D.图象Ⅳ中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是GaN+OH-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$GaO2-+NH3↑.
(2)将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-2 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
(3)工业上电解精炼镓的原理如下:待提纯的粗镓(内含Zn、Fe、Cu杂质)为阳极,高纯度镓为阴极,NaOH溶液为电解质溶液.在电流作用下使粗镓在阳极溶解进入电解质溶液,离子迁移到达阴极并在阴极放出电析出高纯镓.
①已知离子氧化性顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解精炼镓时阳极泥的成分是Fe、Cu.
②GaO2-在阴极放电的电极方程式是GaO2-+3e-+2H2O=Ga+4OH-.
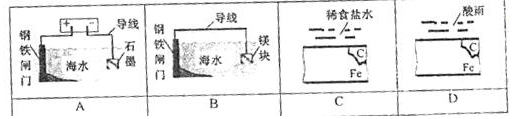
| A. | A | B. | B | C. | C | D. | D |
| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2HI(g)?H2(g)+I2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | D. | C(s)+H2O(g)?H2(g)+CO(g)△H>0 |
$\frac{1}{2}$H2+NiO(OH)$?_{放电}^{充电}$Ni(OH)2.根据此反应判断,下列叙述中正确的是( )
| A. | 电池放电时,电池负极周围溶液的c(OH-)为断增大 | |
| B. | 电池放电时,H2是负极 | |
| C. | 电池放时时,氢元素被氧化 | |
| D. | 电池放电时,镍元素被氧化 |
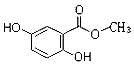
 .
.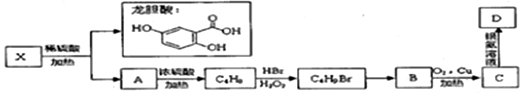
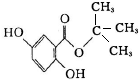 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
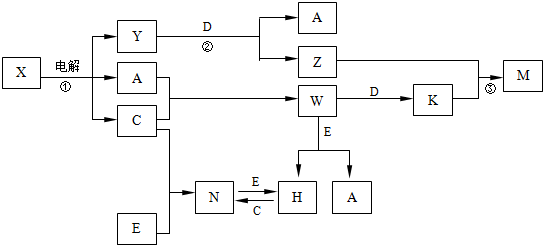
.
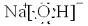 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族