题目内容
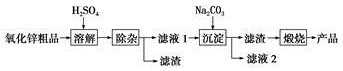
12.高锰酸钾可用于生活消毒,是中学化学常见的氧化剂.工业上,用软锰矿制高锰酸钾的流程如图(部分条件和产物省略):
请回答下列问题:
(1)写出KOH的电子式
 .
.(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O.
(3)从经济性考虑试剂X宜选择(填名称):石灰乳(或生石灰).上述流程中,设计步骤IV和V的目的是循环利用二氧化锰、氢氧化钾,提高原料利用率.
(4)已知:常温下,Ksp[Mn(OH)2]=2.0×10-13.工业上,调节pH沉淀废水中Mn2+.当pH=10时,溶液中c(Mn2+)=2.0×10-5mol•L-1.
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀.当溶液由紫红色刚好褪色且半分钟不变色,表明达到滴定终点.写出离子方程式:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+.
(6)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化.
①阳极反应式为MnO42--e-=MnO4-.
②电解过程中,阴极附近电解质溶液的pH将增大(填:增大、减小或不变).
分析 软锰矿的主要成分为MnO2,由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,向K2MnO4溶液中通入CO2制备KMnO4、还生成K2CO3、MnO2,通过过滤,分离出二氧化锰,滤液中含KMnO4和K2CO3,根据KMnO4和K2CO3在溶解性上不同采用蒸发结晶的方式可分离出高锰酸钾和碳酸钾,对粗高锰酸钾进行重结晶、干燥得到纯净的高锰酸钾;向碳酸钾溶液中加入石灰生成碳酸钙和氢氧化钾,据此分析.
解答 解:(1)KOH为离子化合物,由钾离子和氢氧根离子构成,氢氧化钾的电子式为: ;
;
故答案为: ;
;
(2)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水.反应中锰元素由+4价升高为+6价,总升高2价,氧元素由0价降低为-2价,总共降低4价,化合价升降最小公倍数为4,所以MnO2系数2,O2系数为1,根据锰元素守恒确定K2MnO4系数为2,根据钾元素守恒确定KOH系数为4,根据氢元素守恒确定H2O系数为2,所以反应化学方程式为:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(3)试剂X是将碳酸钾反应生成氢氧化钾,所以从经济性考虑试剂X宜选择石灰乳(或生石灰),上述流程中,步骤IV和V都是物质循环利用,其目的是循环利用二氧化锰、氢氧化钾,提高原料利用率;
故答案为:石灰乳(或生石灰);循环利用二氧化锰、氢氧化钾,提高原料利用率;
(4)pH=10时c(OH-)=10-4mol/L,根据Ksp[Mn(OH)2]=c2(OH-)×c(Mn2+)可知,溶液中c(Mn2)=$\frac{2.0×1{0}^{-13}}{(1{0}^{-4})^{2}}$=2.0×10-5mol•L-1;
故答案为:2.0×10-5mol•L-1;
(5)用高锰酸钾溶液滴定硫酸锰溶液,产生黑色沉淀,高锰酸根离子与锰离子发生价态归中反应,发生反应的离子方程式为2MnO4-?+3Mn2++2H2O=5MnO2↓+4H+;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(6)电解锰酸钾溶液时,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为MnO42--e-=MnO4-,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,则阴极溶液的pH增大;
故答案为:①MnO42--e-=MnO4-②增大.
点评 本题考查常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 1 mol O2中含有1.204×1024个氧原子,在标准状况下占有体积22.4 L | |
| B. | 1 mol O3和1.5 mol O2含有相等的氧原子数 | |
| C. | 等体积、浓度均为1 mol•L-1的磷酸溶液和盐酸,含有的氢元素质量之比为3:1 | |
| D. | 等物质的量的干冰和葡萄糖(C6H12O6)中所含的碳原子数之比为1:6,氧原子数之比为1:3 |
| A. | -332 | B. | +130 | C. | +332 | D. | -l30 |
| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
 有多种同分异构体,其中属于酯类且含有苯环结构的共有( )
有多种同分异构体,其中属于酯类且含有苯环结构的共有( )| A. | 7种 | B. | 6种 | C. | 5种 | D. | 4种 |