题目内容
20.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 1 mol NH4+ 所含质子数为10NA | |
| B. | 10克氖气所含原子数约为6.02×1023 | |
| C. | 常温常压下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
分析 A.1个铵根离子中含有10个电子,11个质子,1mol铵根离子含有11mol质子;
B.稀有气体为单原子分子,10g氖气的物质的量为0.5mol,含有0.5mol氖原子;
C.标准状况下气体摩尔体积为22.4L/mol;
D.32g臭氧和氧气中含有32g氧原子,含有氧原子物质的量=$\frac{32g}{16g/mol}$=2mol;
解答 解:A.1mol铵根离子中含有11mol质子,所含质子数为11NA,故A错误;
B.10g氖气的物质的量为0.5mol,含有0.5mol氖原子,所含原子数约为0.5NA=3.01×1023,故B错误;
C.常温常压下,22.4 L SO2物质的量小于1mol,所含的分子数小于NA ,故C错误;
D.32g臭氧和氧气中含有32g氧原子,32gO原子的物质的量为2mol,所含原子数约为2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意明确标况下气体摩尔体积的使用条件:必须指明在标准状况下、物质的状态必须为气体;明确稀有气体分子为单原子.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
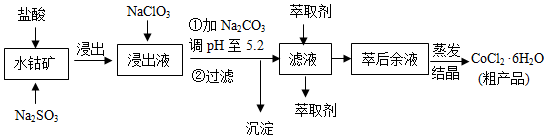
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
15.用低品位铜矿(含CuS、CuO以及杂质FeO及Fe2O3)可制备有机催化剂CuCl,其主要流程如图:

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
回答下列问题
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.
10.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是CO32-;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
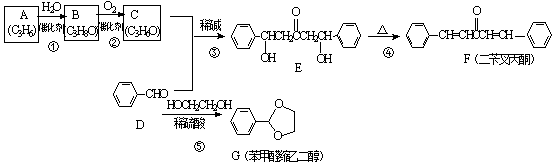
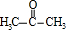 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 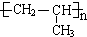 .
.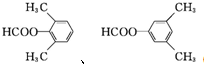 .
.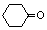 (环已酮)合成
(环已酮)合成 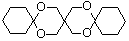 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]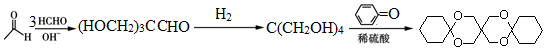 .
.
 .
.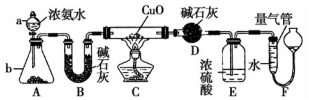 某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题:
某课外活动小组欲利用CuO与NH4反应,研究NH3的某种性质并测定其组成,设计了如图实验装置(夹持装置未画出)进行实验.请回答下列问题: