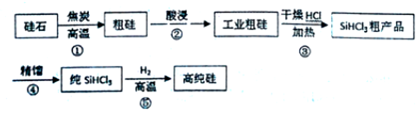
题目内容
3.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=akJ•mol-1;2C(s)+O2(g)=2CO(g)△H=一220kJ•mol-1;H-H、O=O和O-H键的键能分别为436、496和462kJ•mol-1,则a为( )| A. | -332 | B. | +130 | C. | +332 | D. | -l30 |
分析 根据盖斯定律计算水分解反应的焓变,化学反应的焓变△H=H产物-H反应物再结合化学键能和物质能量的关系来回答.
解答 解:已知①C(s)+H2O(g)═CO(g)+H2(g)△H=akJ•mol-1,
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(2a+220)kJ•mol-1,
4×462-496-2×436=2a+220,
解得a=+130.
故选B.
点评 本题考查学生盖斯定律的应用以及化学反应的能量和化学键键能之间的关系,注意知识的迁移和应用是关键,难度中等,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.在25℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g•cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
| A. | 溶质的质量分数为ω=$\frac{a}{ρV}$×100% | |
| B. | 溶质的物质的量浓度c=17 V/1 000 a mol•L-1 | |
| C. | 溶液中c(OH-)=V/1 000b mol•L-1 | |
| D. | 上述溶液中再加入V mL水后,所得溶液的质量分数小于0.5ω |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准状况下,36g 水中所含的氧原子数目为2NA | |
| B. | 在标准状况下,22.4L三氧化硫的物质的量是1mol | |
| C. | 在标准状况下,0.1mol四氯化碳的体积为2.24L | |
| D. | 在标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA |
8.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
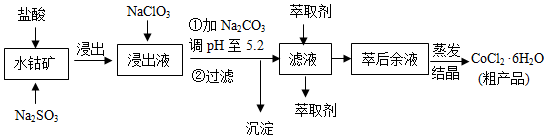
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3,加入萃取剂的目的是除去溶液中的Mn2+.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
15.用低品位铜矿(含CuS、CuO以及杂质FeO及Fe2O3)可制备有机催化剂CuCl,其主要流程如图:

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
回答下列问题
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.

已知:Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,被MnO2氧化的元素有S和Fe(填元素符号),CuS被MnO2及硫酸浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O.
(2)步骤③调整pH的范围为3.7≤pH<4.7,滤渣A的成分为Fe(OH)3(填化学式).
(3)“沉铁”时,需要进行过滤洗涤,检验洗涤是否完全的方法是取少量最后一次的洗涤过滤液于试管中,向其中滴加KSCN溶液(BaCl2溶液),若溶液不显红色(无白色沉淀),则表明已洗涤完全.
(4)准确称取所制备的氯化亚铜样品1.600g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.1000mol•L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00mL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为93.3%.

 .
.