题目内容
19.(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复印机的硒鼓等等.工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为H2SeO3,主要反应为2HCl+H2SeO4═H2SeO3+H2O+Cl2↑,然后向溶液中通入SO2将硒元素还原为单质硒沉淀.据此正确的判断为( )| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
分析 氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合元素的化合价的变化分析.
解答 解:A.反应中Se元素化合价降低,H2SeO4为氧化剂,Cl元素化合价升高,Cl2为氧化产物,氧化还原反应中氧化剂氧化性大于氧化产物的氧化性,则H2SeO4的氧化性比氯气强,故A错误;
B.将二氧化硫通入亚硒酸溶液中出现单质硒的沉淀,可说明氧化性二氧化硒(或亚硒酸)具有氧化性,二氧化硫具有还原性,则二氧化硒的氧化性大于二氧化硫,故B错误;
C.2HCl+H2SeO4→H2SeO3+Cl2+H2O反应中,H2SeO4为氧化剂,H2SeO3为还原产物,则H2SeO4的氧化性比H2SeO3强,故C正确;
D.硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),说明硝酸的氧化性大于H2SeO4,故D错误;
故选C.
点评 本题综合考查氧化还原反应,侧重于学生的分析能力和自学能力的考查,题目难度中等,注意从元素化合价的角度分析相关概念和物质的性质.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
9.有关0.1mol/LNH3•H2O溶液中,下列说法中正确的是( )
| A. | 氨水电离方程式为:NH3•H2O=NH4++OH- | |
| B. | 溶液中有:c(NH4+)+c(H+)=c(OH-) | |
| C. | 溶液中:c(NH3•H2O)=0.1mol/L | |
| D. | 加入少量NaOH固体,溶液中碱性增强,c(H+)•c(OH-)的乘积将增大 |
7.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. | 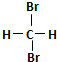 和 和 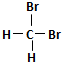 互为同分异构体 互为同分异构体 | ||
| C. | 正丁烷和异丁烷是同系物 | D. | 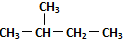 和 和 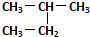 是同一种物质 是同一种物质 |
14.金属可以发生多种反应.其中正确的是( )
| A. | 铜与稀硫酸反应生成氢气 | |
| B. | 铁与水反应生成氢氧化铁和氢气 | |
| C. | 钠投入CuSO4溶液中,可以置换出铜 | |
| D. | 某溶液与铝反应产生氢气,该溶液不一定是酸性溶液 |
4.部分果蔬中含有下列成分:
已知:
①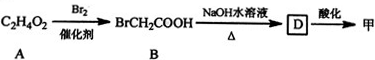
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③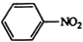 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$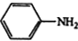 $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$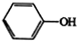
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$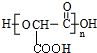 +(n-1)H2O.
+(n-1)H2O.
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$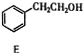 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$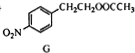 $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 | 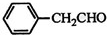 |
①
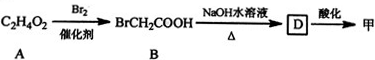
②1mol乙消耗NaHCO3 的物质的量是甲的2倍
③
 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$ $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
回答下列问题:
(1)甲可由已知①得到.
①甲中含有不饱和键的官能团名称为羧基.
②A→B为取代反应,A的结构简式为CH3COOH.
③B→D的化学方程式为BrCH2COOH+2NaOH$→_{△}^{H_{2}O}$HOCH2COONa+NaBr+H2O.
(2)乙在一定条件下生成链状酯类有机高分子化学物的化学方程式为n HOOCCH(OH)COOH$\stackrel{一定条件}{→}$
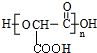 +(n-1)H2O.
+(n-1)H2O.(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):
丙$→_{催化剂,△}^{H_{2}}$
 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$ $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J①用化学方法除去E中残留的少量丙(室温时E和丙呈液态,忽略它们在水中的溶解),第1步加入试剂的名称为新制氢氧化铜或银氨溶液,第2、3 步操作分别是过滤、分液.
②经E→G→H保护的官能团是羟基,可以表征有机化合物中存在何种官能团的仪器是红外光谱仪.
③J的同分异构体中在核磁共振氢谱上显示为两组峰,峰面积比为3:2的链状且不存在支链的异构体共有8种(不含立体异构),其中某异构体L中的官能团都能与H2 发生加成反应,则L的结构简式为CH3CH2COC≡CCOCH2CH3或CH3COCH2C≡CCH2COCH3(只写一种).
12.如图所示实验操作不正确的是( )
| A. |  倾倒液体 | B. |  检查气密性 | C. | 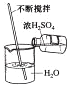 稀释浓硫酸 | D. | 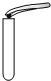 取用固体 |

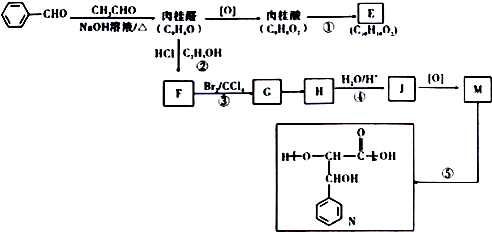
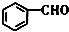 的名称是苯甲醛.
的名称是苯甲醛.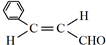 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面. .
.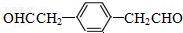 .
.