题目内容
14.金属可以发生多种反应.其中正确的是( )| A. | 铜与稀硫酸反应生成氢气 | |
| B. | 铁与水反应生成氢氧化铁和氢气 | |
| C. | 钠投入CuSO4溶液中,可以置换出铜 | |
| D. | 某溶液与铝反应产生氢气,该溶液不一定是酸性溶液 |
分析 A.铜排在氢后面,不能置换氢气;
B.铁与水蒸气反应生成四氧化三铁和氢气;
C.钠与盐溶液反应,可以理解为先与水反应再与盐反应;
D.依据铝能够与强碱或者酸反应生成氢气的性质解答;
解答 解:A.铜与稀硫酸不反应,故A错误;
B.铁与水蒸气反应生成四氧化三铁和氢气,故B错误;
C.钠投入CuSO4溶液中,反应生成氢氧化铜、硫酸钠和氢气,不会置换出铜,故C错误;
D.铝能够与强碱或者酸反应生成氢气,所以某溶液与铝反应产生氢气,该溶液可能是酸性溶液,也可能是强碱溶液,故D正确;
故选:D.
点评 本题考查了常见金属的性质,熟悉钠、铁、铝的性质是解题关键,侧重考查学生对基础知识掌握熟练程度.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
5.决定元素的化学性质的是( )
| A. | 质子数 | B. | 中子数 | C. | 核电荷数 | D. | 最外层电子数 |
2.在一定温度下,某体积不变的密闭容器中,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是( )
| A. | 混合气体的密度不变 | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内生成2n mol的AB,同时生成n mol的B2 |
19.(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复印机的硒鼓等等.工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为H2SeO3,主要反应为2HCl+H2SeO4═H2SeO3+H2O+Cl2↑,然后向溶液中通入SO2将硒元素还原为单质硒沉淀.据此正确的判断为( )
| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
6.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变为无色.下列分析正确的是( )
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
3.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
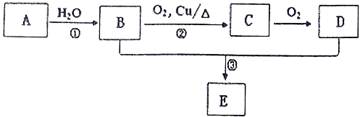
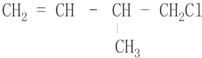
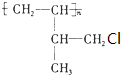 .
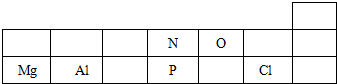
.
 .
.