题目内容
11.在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与反应).某化学研究小组对硫铁矿样品进行如下实验探究:【实验一】测定硫元素的含量
实验装置如图1所示(夹持和加热装置已省略).A中的试剂是双氧水,将m g该硫铁矿样品放人硬质玻璃管D中.从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全.
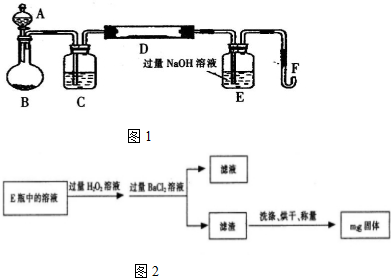
II.反应结束后,将E瓶中的溶液进行如图2处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
1用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
2在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
3将滤液B稀释为250mL;
4取稀释液25.00mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL.
已知:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_浓硫酸;E瓶的作用是_吸收二氧化硫.
(2)11中加入过量H2O2溶液发生反应的离子方程式为H2O2+SO32-═SO42-+H2O.
(3)111的步骤③中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是250mL容量瓶;④中盛装KMnO3溶液的仪器是_酸式滴定管.
(4)假设在整个实验过程中铁元素都没有损失;铁元素的质量分数为$\frac{2.8cV}{{m}_{1}}$×100%.(用含m1、c、v的代数式表示)
分析 (1)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
(2)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水;
(3)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,高锰酸钾溶液具有强氧化性需要盛在酸式滴定管中;
(4)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,依据硫元素守恒计算硫元素质量得到硫元素的质量分数;依据滴定实验消耗的高锰酸钾物质的量结合反应的定量关系计算亚铁离子物质的量,依据铁元素守恒得到样品中含有的铁元素质量分数;
解答 解:(1)装置中生成的氧气含有水蒸气需要在通入玻璃管前除去水蒸气,选用浓硫酸进行干燥;铁矿石和氧气反应生成氧化铁和二氧化硫,E装置是吸收二氧化硫气防止污染环境;
故答案为:浓硫酸,吸收二氧化硫;
(2)Ⅱ中加入过量H2O2溶液发生的反应是过氧化氢氧化亚硫酸根离子生成硫酸根离子,过氧化氢被还原为水,反应的离子方程式为:H2O2+SO32-═SO42-+H2O;
故答案为:H2O2+SO32-═SO42-+H2O;
(3)依据配制一定体积溶液的操作步骤分析,需要在250mL容量瓶中配制,高锰酸钾溶液具有强氧化性需要盛在酸式滴定管中;
故答案为:250mL容量瓶,酸式滴定管;
(4)样品质量为m1g,依据流程分析可知得到硫酸钡沉淀为m2g,硫元素物质的量=硫酸钡物质的量=$\frac{{m}_{2}g}{233g/mol}$=$\frac{{m}_{2}}{233}$mol;依据硫元素守恒计算硫元素质量得到硫元素的质量分数=$\frac{\frac{{m}_{2}}{233}mol×32g/mol}{{m}_{1}g}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$100%;
依据滴定实验消耗的高锰酸钾物质的量结合反应的定量关系计算亚铁离子物质的量,反应的离子方程式为:5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O;
设亚铁离子物质的量为X,
25mL溶液消耗高锰酸钾物质的量=c mol/L×Vml×10-3L/mol=cV×10-3mol
5Fe2+~MnO4-
5 1
X cV×10-3mol
X=5cV×10-3mol
所以250mL溶液中含铁元素物质的量5cV×10-2mol
依据铁元素守恒得到样品中含有的铁元素质量分数=$\frac{5cV×1{0}^{-2}mol×56g/mol}{{m}_{1}g}$×100%=$\frac{2.8cV}{{m}_{1}}$×100%
故答案为:$\frac{2.8cV}{{m}_{1}}$×100%;
点评 本题考查了物质性质的实验探究方法和实验分析判断,过程中的定量计算关系是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 35 | B. | 37 | C. | 36 | D. | 35.5 |
| A. | 混合气体的密度不变 | |
| B. | 容器内的总压强不随时间变化 | |
| C. | 容器中各组分的体积分数不随时间变化 | |
| D. | 单位时间内生成2n mol的AB,同时生成n mol的B2 |
| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
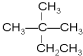 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦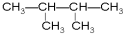 ⑧
⑧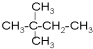 ⑨丙烷
⑨丙烷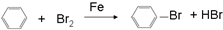 ;
; ;
;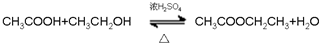 .
. H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).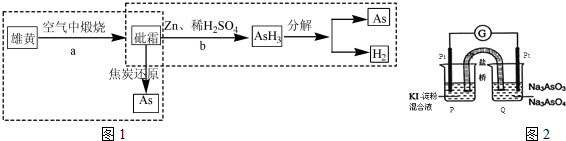
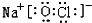 .
.