题目内容
8.卤料桂皮中含有肉桂醛,可参与合成酯类香料E及吸水性高分子聚酯N.合成路线如图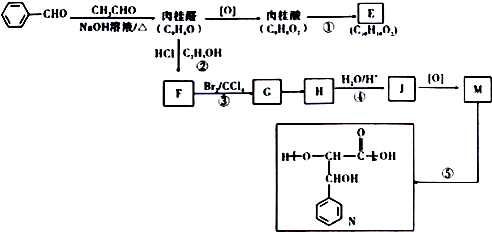
已知:R-CHO+CH3CHO$→_{△}^{NaOH溶液}$R-CH=CH-CHO(R为烃基):RCHO$→_{C_{2}H_{3}OH}^{HCl}$RCH(OC2H5):$\frac{H2O}{H}$RCHO
(1)
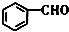 的名称是苯甲醛.
的名称是苯甲醛.(2)肉桂醛的反式结构是
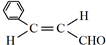 ,分子中最多有18个原子共平面.
,分子中最多有18个原子共平面.(3)①的化学方程式是
 .
.(4)除氧气直接氧化外,由J得到M所需试剂为银氨溶液或者新制氢氧化铜、盐酸或者硫酸,M中所含官能团的名称是羟基、羧基.
(5)合成路线中②、④两个步骤的目的是保护醛基不参与反应.③的反应类型是加成反应.
(6)芳香族化合物P是E的同分异构体.其分子中①有两个相同的官能团且能发生银镜反应,②核磁共振氢谱有三组峰.且峰面积之比是2:2:1,则P的结构简式为
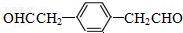 .
.(7)以乙烯为起始原料(无机试剂任选),设计制备CH3CH=CHCHO的合成路线.(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
分析 苯甲醛和乙醛发生题给信息的反应生成肉桂醛,肉桂醛结构简式为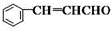 ,肉桂醛被氧化得到肉桂酸,肉桂酸结构简式为
,肉桂醛被氧化得到肉桂酸,肉桂酸结构简式为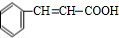 ,根据E的分子式,推出反应①为肉桂酸和甲醇发生酯化反应生成E为
,根据E的分子式,推出反应①为肉桂酸和甲醇发生酯化反应生成E为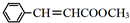 .肉桂醛发生信息中反应生成F为
.肉桂醛发生信息中反应生成F为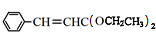 ,F与溴单质发生加成反应生成G为
,F与溴单质发生加成反应生成G为 ,由N的结构简式可知M为
,由N的结构简式可知M为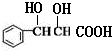 ,逆推可知J为
,逆推可知J为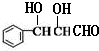 ,则由信息中反应推出H为
,则由信息中反应推出H为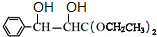 ,据此答题.
,据此答题.
解答 解:苯甲醛和乙醛发生题给信息的反应生成肉桂醛,肉桂醛结构简式为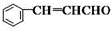 ,肉桂醛被氧化得到肉桂酸,肉桂酸结构简式为
,肉桂醛被氧化得到肉桂酸,肉桂酸结构简式为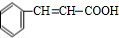 ,根据E的分子式,推出反应①为肉桂酸和甲醇发生酯化反应生成E为
,根据E的分子式,推出反应①为肉桂酸和甲醇发生酯化反应生成E为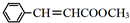 .肉桂醛发生信息中反应生成F为
.肉桂醛发生信息中反应生成F为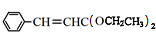 ,F与溴单质发生加成反应生成G为
,F与溴单质发生加成反应生成G为 ,由N的结构简式可知M为
,由N的结构简式可知M为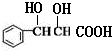 ,逆推可知J为
,逆推可知J为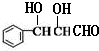 ,则由信息中反应推出H为
,则由信息中反应推出H为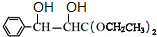
(1) 的名称是苯甲醛,故答案为:苯甲醛;
的名称是苯甲醛,故答案为:苯甲醛;
(2)根据以上分析,肉桂醛结构简式为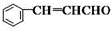 ,其反式结构是
,其反式结构是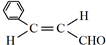 ,分子中最多所有原子即18个原子共平面
,分子中最多所有原子即18个原子共平面
故答案为: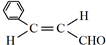 ;18;
;18;
(3)根据以上分析,反应①为肉桂酸和甲醇发生酯化反应生成E,化学方程式是: ,
,
故答案为: ;
;
(4)根据以上分析,J为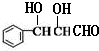 ,M为
,M为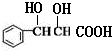 ,所以由J得到M除氧气直接氧化外,还可用银氨溶液或者新制氢氧化铜将醛基氧化成羧酸盐,再加盐酸或者硫酸酸化得到酸,则所需试剂为银氨溶液或者新制氢氧化铜、盐酸或者硫酸;M中所含官能团的名称是羟基、羧基;
,所以由J得到M除氧气直接氧化外,还可用银氨溶液或者新制氢氧化铜将醛基氧化成羧酸盐,再加盐酸或者硫酸酸化得到酸,则所需试剂为银氨溶液或者新制氢氧化铜、盐酸或者硫酸;M中所含官能团的名称是羟基、羧基;
故答案为:银氨溶液或者新制氢氧化铜、盐酸或者硫酸;羟基、羧基;
(5)合成路线中②、④两个步骤的目的是保护醛基不参与反应,反应③为F与溴单质发生加成反应生成G,则反应类型是加成反应,故答案为:保护醛基不参与反应;加成反应;
(6)E结构简式为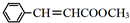 ,P是E的同分异构体,P的结构简式符合下列条件:
,P是E的同分异构体,P的结构简式符合下列条件:
①有两个相同的官能团且能发生银镜反应,说明含有2个醛基;②核磁共振氢谱有三组峰.且峰面积之比是2:2:1,说明该分子结构具有对称性.
则符合条件的P有机物结构简式为: ,故答案为:
,故答案为: ;
;
(7)乙烯与HBr发生加成反应生成CH3CH2Br,然后发生水解反应生成CH3CH2OH,再发生氧化反应生成CH3CHO,2分子乙醛在氢氧化钠加热条件下发生反应生成CH3CH=CHCHO,合成路线流程图为:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{△}^{NaOH溶液}$CH3CH=CHCHO,故答案为:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{△}^{O_{2}/Cu}$CH3CHO$→_{△}^{NaOH溶液}$CH3CH=CHCHO.
点评 本题考查有机推断与合成,侧重考查学生分析判断及知识迁移能力,熟练掌握常见官能团及其性质关系、常见反应条件,难度中等.

 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案| A. | 1NA个氢气分子所占的体积为22.4 L | |
| B. | 2NA个二氧化碳分子的质量为88 g | |
| C. | 0.1 mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA | |
| D. | 17 g NH3中所含原子数为NA |
| A. | H2SeO4的氧化性比Cl2弱 | B. | SeO2的氧化性比SO2弱 | ||
| C. | H2SeO4的氧化性比H2SeO3强 | D. | 浓H2SeO4的氧化性比HNO3强 |
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
| A. | 氯化氢能使湿润的蓝色石蕊试纸变为红色,是因为HCl分子中含有H+ | |
| B. | 氯化氢极易溶于水,常温常压下1体积水可溶解500体积HCl | |
| C. | 氯化氢可以用向上排空气法收集 | |
| D. | 氯化氢和盐酸的化学式都是HCl |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.(2)形成化合物种类最多的元素是C(填元素符号),其稳定氧化物的结构式为O=C=O.
(3)⑤、⑥、⑦、⑧四种元素所对应的气态氢化物最稳定的是H2O,最不稳定的是SiH4(均填化学式).
(4)以上第三周期元素中的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式),二者发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)①、②、③的原子半径由大到小的顺序为K>Na>Mg(填元素符号).
(6)⑦元素的氢化物在常温下与①发生反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(7)③、④两元素相比较,金属性较强的是Mg(填元素符号),可以验证该结论的方法有ACD(填编号).
A.将这两种元素的块状单质分别放入热水中看与水反应的剧烈程度
B.比较二者与某非金属反应时失电子数目多少
C.比较二者的最高价氧化物的水化物碱性强弱
D.看形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应的剧烈程度.
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
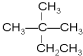 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦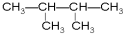 ⑧
⑧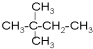 ⑨丙烷
⑨丙烷 ;
; ;
; .
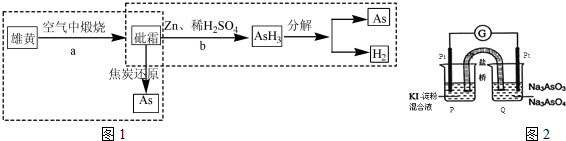
. H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).
H2AsO3-+OH(用离子方程式表示),该溶液中c(H2AsO3-)>c(AsO33-)(填”>”、“<”或“=”).