题目内容
11.溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是( )| A. | 它们与NaOH完全中和时,醋酸溶液所消耗的NaOH少 | |
| B. | 它们分别与足量CaCO3反应时,放出的CO2一样多 | |
| C. | 两种溶液的n(Cl-)=n(CH3COO-)相同 | |
| D. | 分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
分析 盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,pH相同的醋酸和盐酸,溶液中c(H+)相同,但是醋酸的浓度大于盐酸,据此分析.
解答 解:A.pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,所以等体积时,醋酸的物质的量多,所以消耗的NaOH多;故A错误;
B.它们分别与足量CaCO3反应时,醋酸的物质的量多,与醋酸反应生成的CO2多,故B错误;
C.两种溶液中c(H+)相同,由电荷守恒可知,c(H+)=c(Cl-)+c(OH-),c(H+)=c(CH3COO-)+c(OH-),所以两种溶液的n(Cl-)=n(CH3COO-)相同,故C正确;
D.分别用水稀释相同倍数时,促进醋酸的电离,醋酸中醋酸根离子的物质的量增大,而盐酸中氯离子的物质的量不变,所以n(Cl-)<n(CH3COO-),故D正确.
故选AB.
点评 本题考查了弱电解质的电离平衡应用、溶液pH的变化、溶液稀释后溶液中离子浓度的分析判断,把握弱电解质的电离平衡变化分析是解题关键,题目难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
2.下列说法不正确的是( )
| A. | 石油的分馏可以得到烷烃、环烷烃、芳香烃等产品 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 用于奥运火炬的丙烷是一种清洁燃料 |
19.下列化合物的结构中,只含有离子键的是( )
| A. | H2O | B. | NaCl | C. | NaOH | D. | CO2 |
16.下列说法不正确的是( )
| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | “血液透析”的原理利用了胶体的性质 | |
| C. | 食品包装中常放入有硅胶和铁粉的小袋,只能防止食物受潮 | |
| D. | 煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾. |
20.下列叙述都涉及有机化学相关知识,其中正确的是( )
| A. | 烧菜时加少量的醋和料酒会使菜味清香可口,是因为醋酸和酒精都具有香味 | |
| B. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| C. | 一定条件下,稻草可制得酒精和氨基酸 | |
| D. | 氟利昂(CF2Cl2)会破坏大气臭氧层,从而导致“温室效应” |
1.用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
Pb+PbO2+4HBF4$?_{放电}^{充电}$2Pb(BF4)2+2H2O;
Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
| A. | 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O | |
| B. | 充电时,当阳极质量增加23.9 g时,溶液中有0.2 mol电子通过 | |
| C. | 放电时,正极区pH增大 | |
| D. | 充电时,Pb电极与电源的正极相连 |
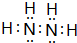
 .
.
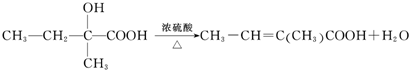
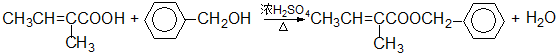
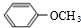

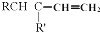
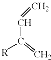 +
+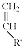 $\stackrel{△}{→}$
$\stackrel{△}{→}$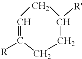
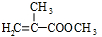 .
.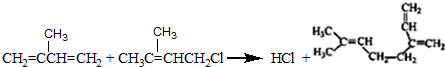 .
.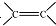 和
和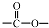 结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式
结构的D的所有同分异构共有9种(含顺反异构体),写出其中任意一种含反式结构的结构简式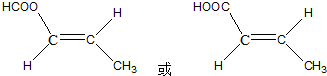 .
.