��Ŀ����
1��A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ��������ԭ���а뾶��С��ԭ�ӣ�BԪ�ص�����������Ӧˮ���������⻯������һ����X��D��Aͬ���壬����Eͬ���ڣ�EԪ�ص��������������������������3/4��A��B��D��E������Ԫ���У�ÿһ�ֶ���CԪ���γ�ԭ�Ӹ����Ȳ���ͬ�Ļ������ش��������⣺
��1��C��E��Ԫ����Ƚϣ��ǽ����Խ�ǿ����������Ԫ�����ƣ���������֤�ý��۵���CD����д��ţ���
A���Ƚ�������Ԫ�ص���̬�⻯��ķе�
B���Ƚ�������Ԫ�صĵ����ڳ����µ�״̬
C���Ƚ�������Ԫ�ص���̬�⻯����ȶ���
D���Ƚ�������Ԫ�صĵ������������ϵ�����
��2��д��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�������E��C��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��2�Ļ����ﷴӦ�Ļ�ѧ����ʽ��Na2O2+SO2=Na2SO4��
��3��A��C��D��E����Ԫ�ؿ��γ�������ʽ�Σ�������ʽ�����Ӧ�����ӷ���ʽΪH++HSO3-=H2O+SO2����
��4��A��E��A��C���γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ�������ҷ�Ӧ�����ӷ���ʽΪHS-+OH-=S2-+H2O��
��5��BԪ�ص���̬�⻯�����һ�ֳ��������˫ԭ�ӷ��ӣ��ܷ�Ӧ����B�ĵ��ʣ��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ2��3��
��6���ڻ���ƽ�����װ��Һ̬B2A4��Һ̬A2C2����֪0.4mol��Һ̬B2A4������Һ̬A2C2��Ӧ��������̬B2����̬A2C���ų�256.6kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=-641.5kJ•mol-1��B2A4�ĵ���ʽ
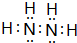
��7��A2C�ķе��A2E �е�ߣ�ԭ����ˮ���Ӽ�������
��8��������ʵ������������͵���BCD
A��ˮ�������ȶ���
B��������Һ����
C��������������ˮ��
D��ˮ��ɱ����ܶȼ�С���������
��9���õ���ʽ��ʾ�Ȼ�����γɹ���
 ��
��
���� A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ��������ԭ���а뾶��С��ԭ�ӣ���AΪHԪ�أ�BԪ�ص�����������Ӧˮ���������⻯����������X����BΪNԪ�أ�XΪNH4NO3��D��Aͬ���壬D��ԭ���������ڵ�����DΪNa��D��Eͬ���ڣ������ڵ������ڣ�EԪ��ԭ�ӵ��������������������������$\frac{3}{4}$����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�Ķ��ֻ������CΪOԪ�أ�
��1��ͬ�������϶��·ǽ����Լ�����
�Ƚ��⻯���ȶ��Ի������������ϵ����׳̶ȡ���ۺ���������ԡ���������Ԫ�ػ��ϼ۵ȿ����жϷǽ�����ǿ�����������ʲ����жϷǽ�����ǿ����
��2��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2��E��C��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ΪSO2�����߷�Ӧ����Na2SO4��
��3��H��O��Na��S����Ԫ�ؿ��γ�������ʽ��ΪNaHSO3��NaHSO4�����߷�Ӧ���������ơ�����������ˮ��
��4��H��S��H��O���γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ����ΪHS-����ΪOH-�����߷�Ӧ����������ˮ��
��5��NԪ�ص���̬�⻯�ﰱ������һ�ֳ��������˫ԭ�ڷ��ӣ�NO�ܷ�Ӧ���ɵ������÷�Ӧ�����������뻹ԭ���ﶼ�ǵ��������ݵ���ת���غ�������������뻹ԭ��������ʵ���֮�ȣ�
��6������1molҺ̬N2H4��Ӧ�ų���������ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
N2H4��Nԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ�
��7��ˮ���Ӽ����������е��������ģ�
��8��A�����Ӱ���������ʣ�ˮ�������ȶ���������OԪ�طǽ����Ա�S��ǿ��
B����������֮�����������е�ϸߣ�
C������������ˮ����֮���γ������
D��ÿ��ˮ��������Χ��4��ˮ����֮���γ�4��������γɡ���϶�����������
��9��HCl���ڹ��ۻ������Hԭ�ӡ�Clԭ�ӵ���ʽ��ʾ�Ȼ�����γɣ�
��� �⣺A��B��C��D��E���ֶ�����Ԫ�أ����ǵ�ԭ��������������AԪ��������ԭ���а뾶��С��ԭ�ӣ���AΪHԪ�أ�BԪ�ص�����������Ӧˮ���������⻯����������X����BΪNԪ�أ�XΪNH4NO3��D��Aͬ���壬D��ԭ���������ڵ�����DΪNa��D��Eͬ���ڣ������ڵ������ڣ�EԪ��ԭ�ӵ��������������������������$\frac{3}{4}$����EΪSԪ�أ�A��B��D��E������Ԫ�أ�ÿһ����CԪ�ض����γ�Ԫ�ص�ԭ�Ӹ����Ȳ���ͬ�Ķ��ֻ������CΪOԪ�أ�
��1��ͬ�������϶��·ǽ����Լ���������Ԫ�صķǽ����Ա����ǿ���Ƚ��⻯���ȶ��Ի������������ϵ����׳̶ȵȿ����жϷǽ�����ǿ�������ʵķе����������ԣ������жϷǽ�����ǿ�����⻯��е�Ҳ�����жϷǽ�����ǿ����
�ʴ�Ϊ������CD��
��2��C��D��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2��E��C��Ԫ���γɵ�ԭ�Ӹ�����Ϊ1��2�Ļ�����ΪSO2�����߷�Ӧ����ʽΪ��Na2O2+SO2=Na2SO4��
�ʴ�Ϊ��Na2O2+SO2=Na2SO4��
��3��H��O��Na��S����Ԫ�ؿ��γ�������ʽ��ΪNaHSO3��NaHSO4�����߷�Ӧ�����ӷ���ʽΪ��H++HSO3-=H2O+SO2����
�ʴ�Ϊ��H++HSO3-=H2O+SO2����
��4��H��S��H��O���γɼס��������������Ǿ�Ϊ��һ��˫ԭ�������ӣ��Ҽ���18�����ӣ�����10�����ӣ����ΪHS-����ΪOH-��������ҷ�Ӧ�����ӷ���ʽΪHS-+OH-=S2-+H2O��
�ʴ�Ϊ��HS-+OH-=S2-+H2O��
��5��NԪ�ص���̬�⻯�ﰱ������һ�ֳ��������˫ԭ�ڷ��ӣ�NO�ܷ�Ӧ���ɵ������÷�Ӧ�����������뻹ԭ���ﶼ�ǵ��������ݵ���ת���غ��֪�����������뻹ԭ��������ʵ���֮��Ϊ��2-0����[0-��-3��]=2��3��
�ʴ�Ϊ��2��3��
��6��0.4molҺ̬N2H4������Һ̬H2O2��Ӧ��������̬N2����̬H2O���ų�256.6kJ����������1molҺ̬N2H4��Ӧ�ų�������Ϊ256.6kJ��$\frac{1mol}{0.4mol}$=641.5kJ���ʸ÷�Ӧ���Ȼ�ѧ����ʽΪ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=-641.5kJ•mol-1��
N2H4�ĵ���ʽΪ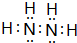 ��
��
�ʴ�Ϊ��N2H4��l��+2 H2O2��l��=N2��g��+4H2O��g����H=-641.5kJ•mol-1��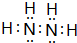 ��
��
��7��ˮ���Ӽ���������H2O�ķе��H2S �е�ߣ�
�ʴ�Ϊ���ߣ�ˮ���Ӽ���������
��8��A��ˮ�������ȶ���������OԪ�طǽ����Ա�S��ǿ��������أ���A����
B����������֮�����������е�ϸߣ�������Һ������B��ȷ��
C������������ˮ����֮���γ������������������ˮ����C��ȷ��
D��ÿ��ˮ��������Χ��4��ˮ����֮���γ�4��������γɡ���϶����ˮ��ɱ����ܶȼ�С���������D��ȷ��
��ѡ��BCD��
��9���õ���ʽ��ʾ�Ȼ�����γɹ��̣� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼��λ�ýṹ���ʵ�Ӧ�ã��ƶ�Ԫ���ǽ���ؼ�����Ŀ�ۺ���ǿ����Ҫѧ���߱���ʵ�Ļ���������ƴ������Ŀ��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�| A�� | CO2�ĵ���ʽΪ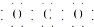 | B�� | Cl-�Ľṹʾ��ͼΪ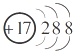 | ||
| C�� | NaCl�ĵ���ʽΪNa+Cl- | D�� | HCl�ĵ���ʽΪHCl |
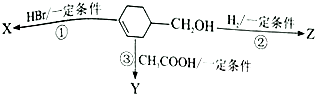 ���
�л���  �ɷ�������ͼʾ��Ӧ����֪����Y����֬�࣮����˵����ȷ���ǣ�������
�ɷ�������ͼʾ��Ӧ����֪����Y����֬�࣮����˵����ȷ���ǣ�������| A�� | ��Ӧ�۵�������ϡ���ᡢ���� | B�� | ��Ӧ�٢ڵ����Ͳ�������ͬ | ||
| C�� | �л�����X��һ�ִ����� | D�� | Y��Z����ʹ���Ը��������Һ��ɫ |
| A�� | �������ϩ | B�� | ����ͱ�ϩ | C�� | �������ϩ | D�� | ����ͱ�ϩ |
| A�� | NH3��0.002 mol•L-1•s-1 | B�� | H2O��0.0015 mol•L-1•s-1 | ||
| C�� | NO��0.0015 mol•L-1•s-1 | D�� | O2��0.00125 mol•L-1•s-1 |
| A�� | ����Ԫ�ط���ΪO | |
| B�� | ���ĺ�������Ų�ʽΪ1s22s22p63s23p4 | |
| C�� | �����⻯��ĵ���ʽΪ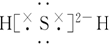 | |
| D�� | ������Ų�ͼΪ 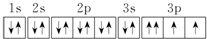 |
| A�� | ������NaOH��ȫ�к�ʱ��������Һ�����ĵ�NaOH�� | |
| B�� | ���Ƿֱ�������CaCO3��Ӧʱ���ų���CO2һ���� | |
| C�� | ������Һ��n��Cl-��=n��CH3COO-����ͬ | |
| D�� | �ֱ���ˮϡ����ͬ����ʱ��n��Cl-����n��CH3COO-�� |
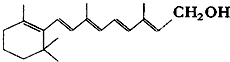 ��֪ά����A1�ļ���ʽ���£��ߵĽ�����˵㴦����̼ԭ�ӣ�������ԭ�Ӳ����ļۣ���C��Hԭ��δ��dz�����
��֪ά����A1�ļ���ʽ���£��ߵĽ�����˵㴦����̼ԭ�ӣ�������ԭ�Ӳ����ļۣ���C��Hԭ��δ��dz�����