题目内容
18.下列有关2个电化学装置的叙述正确的是( )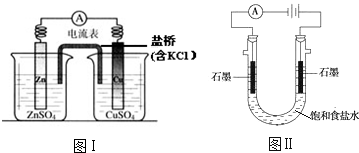
| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
分析 A、活泼金属锌失去电子,电子沿导线流向正极,内电路离子的定向移动,构成闭合回路;
B、Na2SO4替换ZnSO4,负极仍是锌放电,原电池中的铜本身未参与电极反应;
C、溶液中氢离子来源于水的电离,氢离子浓度很小;
D、阳极是氯离子放电,生成氯气,氯离子放电结束后是水电离出的氢氧根离子放电.
解答 解:A、活泼金属锌失去电子,电极反应式为:Zn-2e-═Zn2+,电子沿导线流向正极,正极Cu2++2e-═Cu,内电路离子的定向移动,构成闭合回路,才是电流形成的完整过程,故A错误;
B、Na2SO4替换ZnSO4,负极仍是锌放电,原电池中的铜本身未参与电极反应,所以可用能导电的石墨替换Cu棒,故B正确;
C、溶液中氢离子来源于水的电离,氢离子浓度很小,所以通电后Na+先从阳极区移动到阴极,阴极周围的水电离出氢离子在阴放电,故C错误;
D、阳极是氯离子放电,生成酸性气体氯气,氯离子放电结束后是水电离出的氢氧根离子放电,导致阳极附近pH降低,故D错误;
故选B.
点评 本题考查原电池原理和电解池,明确电子的流向是解本题的关键,再结合电池反应式来分析解答即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H<0.一定条件下测得反应过程中n(Cl2)的实验数据如下.下列说法正确的是( )
表一
表二
表一
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
9.下列技术应用中,其工作原理不涉及化学反应的是( )
| A. |  火炬燃烧 | B. |  风力发电 | C. |  粮食酿醋 | D. |  高炉炼铁 |
6.下列物质不属于高分子化合物的是( )
| A. | 油脂 | B. | 羊毛 | C. | 淀粉 | D. | 橡胶 |
10.无论在酸性溶液还是在碱性溶液中,一定都不能大量存在的离子是( )
| A. | Al3+ | B. | K+ | C. | HS- | D. | A1O2- |
7.下列反应中,硝酸既表现酸性,又表现氧化性的是( )
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
8.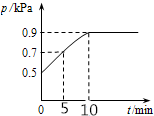 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
 与
与
 和
和
 和
和