题目内容
7.下列反应中,硝酸既表现酸性,又表现氧化性的是( )| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
分析 硝酸既表现酸性,又表现氧化性,说明反应过程中部分硝酸中元素化合价不变,部分硝酸中得电子化合价降低,根据元素化合价来分析解答.
解答 解:A.Fe2O3和HNO3反应生成硝酸铁和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故A错误;
B.氢氧化铝与硝酸反应反应生成硝酸铝和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故B错误;
C.CuO跟稀硝酸反应生成硝酸铜和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故C错误;
D.Fe(OH)2跟稀硝酸反应生成硝酸铁和一氧化氮与水,硝酸既表现酸性,又表现氧化性,故D正确;
故选D.
点评 本题考查硝酸的性质,题目难度不大,本题注意硝酸酸性与氧化性的判断,注意根据物质的性质分析.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
17.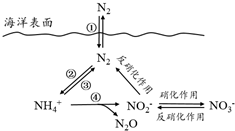 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是②(填图中数字序号).
(2)下列关于海洋氮循环的说法正确的是ad(填字母序号).
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4++5O2═2NO2-+6H++N2O+5H2O
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10L人工海水样本的监测数据:
硝化细菌去除氨氮的最佳反应温度是25℃,在最佳反应温度时,48h内去除氨氮反应的平均速率是1.125mg•L-1•h-1.
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放.图是间接氧化工业废水中氨氮(NH4+)的示意图.
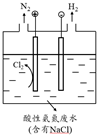
①结合电极反应式简述间接氧化法去除氨氮的原理:阳极反应2Cl--2e-=Cl2,产生的Cl2氧化废水中的NH4+释放出N2.
②若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将减小(填“增大”、“不变”或“减小”),请简述理由:电路中通过相同电量时,若生成n(H2):n(N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是②(填图中数字序号).
(2)下列关于海洋氮循环的说法正确的是ad(填字母序号).
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4++5O2═2NO2-+6H++N2O+5H2O
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10L人工海水样本的监测数据:
| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放.图是间接氧化工业废水中氨氮(NH4+)的示意图.

①结合电极反应式简述间接氧化法去除氨氮的原理:阳极反应2Cl--2e-=Cl2,产生的Cl2氧化废水中的NH4+释放出N2.
②若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将减小(填“增大”、“不变”或“减小”),请简述理由:电路中通过相同电量时,若生成n(H2):n(N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
18.下列有关2个电化学装置的叙述正确的是( )
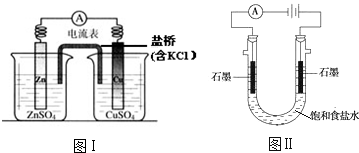

| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
15.某溶液能溶解Al(OH)3,则此溶液中可能大量共存的离子组是( )
| A. | Fe3+、NH4+、SCN-、Cl- | B. | K+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | A13+、Na+、A1O2-、SO42- |
2.下列有关能量的说法正确的是( )
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
12.氢气是清洁的能源,也是重要的化工原料,有关氢气的制取研究是一个有趣的课题.根据提供两种制氢方法,完成下列各题:
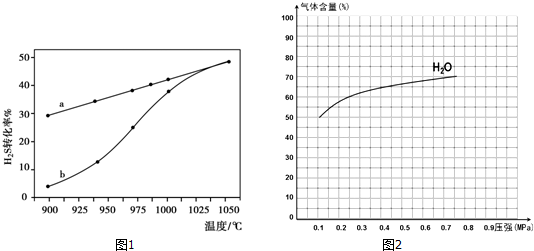
(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H
在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图1所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=$\frac{0.4c}{t}$mol•L-1•min-1(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
①反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g)K=K1•K2•K3.(用K1、K2、K3表示)
②图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图2.若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol•L-1,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图.
③对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度
B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量
D.增加CaO的量,提高CO2的吸收率?
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).

(1)方法一:H2S热分解法,反应式为:2H2S(g)?2H2(g)+S2(g)△H
在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图1所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H>0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=$\frac{0.4c}{t}$mol•L-1•min-1(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:温度升高,反应速率加快,达到平衡所需时间缩短.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: Ⅰ:C(s)+H2O(g)═CO(g)+H2(g) K1 Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2 Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 V:CaCO3(s)═CaO(s)+CO2(g) |
②图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图2.若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol•L-1,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图.
③对于可逆反应C(s)+2H2O(g)+CaO(s)?CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是AC.(填字母编号)
A.降低体系的温度
B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量
D.增加CaO的量,提高CO2的吸收率?
(3)方法二与方法一相比其优点有实现了吸收剂CaO的循环,降低能耗(写一个即可).
19.室温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
5.在绝热情况下向四份0.1mol/L的醋酸钠溶液中分别加入少量KNO3固体、硫酸氢钾固体、氯化钠固体和硫酸铜粉末(忽略溶液体积变化),则c(Ac-)/c(Na+)的变化正确的是( )
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |