题目内容
10.无论在酸性溶液还是在碱性溶液中,一定都不能大量存在的离子是( )| A. | Al3+ | B. | K+ | C. | HS- | D. | A1O2- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质,则离子大量共存,以此来解答.
解答 解:A.Al3+不与酸反应,能与酸共存,故A错误;
B.钾离子既不与酸反应又不与碱反应,能与酸或碱共存,故B错误;
C.HS-既能与酸反应也能与碱反应生成水,不能共存,故C正确;
D.A1O2-不与碱反应,能与碱共存,故D错误.
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
20.空气污染已成为人类社会面临的重大威胁.下列气体不属于大气污染物的是( )
| A. | NO | B. | CO2 | C. | SO2 | D. | NO2 |
18.下列有关2个电化学装置的叙述正确的是( )
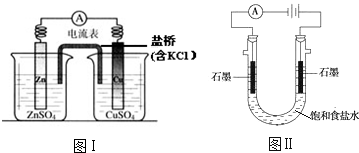

| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
15.某溶液能溶解Al(OH)3,则此溶液中可能大量共存的离子组是( )
| A. | Fe3+、NH4+、SCN-、Cl- | B. | K+、Na+、SO42-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | A13+、Na+、A1O2-、SO42- |
2.下列有关能量的说法正确的是( )
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
19.室温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
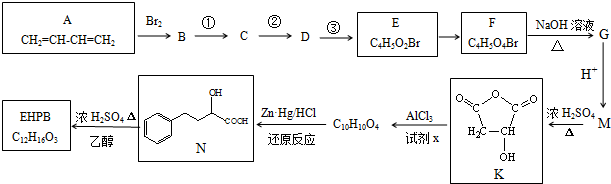
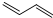 +Cl2$\stackrel{1,2-加成}{→}$
+Cl2$\stackrel{1,2-加成}{→}$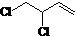 $\stackrel{1,4-加成}{→}$
$\stackrel{1,4-加成}{→}$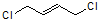
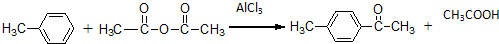
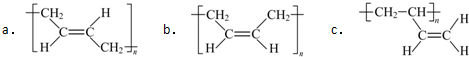
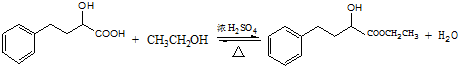 .
.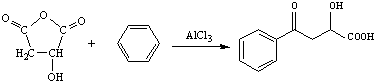 .
.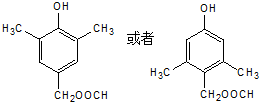 .
.