题目内容
8.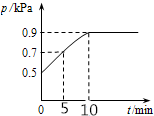 在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在10L密闭容器中放入0.50 mol X,在一定温度下发生反应:X(g)?2Y(g)+Z(s)△H>0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 该温度下此反应的平衡常数K=0.64mol/L | |
| B. | 从反应开始到t1时的平均反应速率v(X)=0.008mol/(L•min) | |
| C. | 欲提高平衡体系中Y的体积分数,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
分析 A、在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,求算K;
B、在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算P为0.7KPa时,反应掉X的物质的量求算;
C、Y为固体,改变Y的物质的量对平衡没有影响;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低.
解答 解:A、设反应的X物质的量为x,
X(g)?2Y(g)+Z(s)
起始量(mol) 0.50 0 0
转化量(mol) x 2x
平衡量(mol)0.50-x 2x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.5-x+2x}{0.5}$=$\frac{0.9}{0.5}$,x=0.4,容器体积为10L,所以K=$\frac{0.0{8}^{2}}{0.01}$mol/L=0.64mol/L,故A正确;
B、设反应的X物质的量为x,
X(g)?2Y(g)+Z(s)
起始量(mol) 0.50 0
转化量(mol) x 2x
0.7KPa量(mol)0.50-x 2x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.5-x+2x}{0.5}$=$\frac{0.7}{0.5}$,x=0.2,所以v(X)=$\frac{\frac{0.2mol}{10L}}{5min}$=0.004mol/(L•s),故B错误;
C、Y为固体,改变Y的物质的量对平衡没有影响,故C错误;
D、恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选A.
点评 本题考查了三段式法在平衡计算中的应用以及化学平衡的移动,题目难度中等,对学生的理解能力和分析能力有一定的要求,注意正确读取图中的相关数据,注意基础知识的灵活运用.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案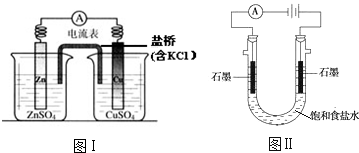
| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
| A. | 0.2mol/LNH3.H2O溶液与0.1mol/L盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COOH)>c(CH3COO-) | |
| C. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c (Na+)=c (SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L Na2CO3溶液与0.1mol/LNaHSO4溶液等体积混合所得溶液:c(CO32-)+2 c(OH-)═c(HCO3-)+c(H2CO3)+2c(H+) |
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
(1)1m3(标准状况)CH4按上式完全反应,产生H2134mol.
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应.1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为3<V<4.
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,$\frac{V(H_{2})}{V(N_{2})}$=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为(3-7a):3.
| A. | 增大、增大、不变、减小 | B. | 减小、增大、不变、减小 | ||
| C. | 增大、减小、减小、减小 | D. | 增大、减小、减小、增大 |