题目内容
8.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H<0.一定条件下测得反应过程中n(Cl2)的实验数据如下.下列说法正确的是( )表一
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.相同时间内氯气物质的量变化越大,说明反应速率越快;
B.根据v=$\frac{\frac{△n}{V}}{△t}$进行判断;
C.正反应为气体体积减小的反应,增大压强平衡正向移动;
D.正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:A.相同时间内,0~2min内氯气变化量为1.8×10-3 mol,而4~6min内氯气变化量为(5.4-3.7)×10-3 mol=1.7×10-3 mol,则0~2min的反应速率大于4~6min的反应速率,故A错误;
B.容器容积未知,用单位时间内浓度变化量无法表示氯气反应速率,故B错误;
C.正反应为气体体积减小的反应,增大压强平衡正向移动,可以提高HCl转化率,故C正确;
D.正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,则平衡常数K(200℃)>K(400℃),故D错误,
故选:C.
点评 本题甲醇化学反应速率、化学平衡影响因素、化学平衡常数影响因素,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
18.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,28g CO中含有的分子数为NA | |
| B. | 1.0 mol•L-1 Na2SO4溶液中所含的Na+数为2NA | |
| C. | 标准状况下,22.4 L HCl气体中所含的原子数为NA | |
| D. | 1 mol N2所含有的原子数为NA |
16.铝片分别与①稀盐酸、②NaOH溶液反应,下列描述正确的是( )


| A. | ①中产生气泡,②中不产生气泡 | |
| B. | ①和②中都不产生气泡 | |
| C. | ①和②中都产生气泡,①中是H2,②中是O2 | |
| D. | ①和②中都产生气泡,且都是H2 |
3. 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
20.空气污染已成为人类社会面临的重大威胁.下列气体不属于大气污染物的是( )
| A. | NO | B. | CO2 | C. | SO2 | D. | NO2 |
17.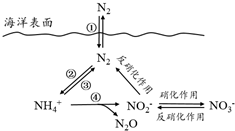 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是②(填图中数字序号).
(2)下列关于海洋氮循环的说法正确的是ad(填字母序号).
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4++5O2═2NO2-+6H++N2O+5H2O
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10L人工海水样本的监测数据:
硝化细菌去除氨氮的最佳反应温度是25℃,在最佳反应温度时,48h内去除氨氮反应的平均速率是1.125mg•L-1•h-1.
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放.图是间接氧化工业废水中氨氮(NH4+)的示意图.
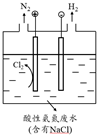
①结合电极反应式简述间接氧化法去除氨氮的原理:阳极反应2Cl--2e-=Cl2,产生的Cl2氧化废水中的NH4+释放出N2.
②若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将减小(填“增大”、“不变”或“减小”),请简述理由:电路中通过相同电量时,若生成n(H2):n(N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是②(填图中数字序号).
(2)下列关于海洋氮循环的说法正确的是ad(填字母序号).
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4++5O2═2NO2-+6H++N2O+5H2O
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10L人工海水样本的监测数据:
| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放.图是间接氧化工业废水中氨氮(NH4+)的示意图.

①结合电极反应式简述间接氧化法去除氨氮的原理:阳极反应2Cl--2e-=Cl2,产生的Cl2氧化废水中的NH4+释放出N2.
②若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将减小(填“增大”、“不变”或“减小”),请简述理由:电路中通过相同电量时,若生成n(H2):n(N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
18.下列有关2个电化学装置的叙述正确的是( )
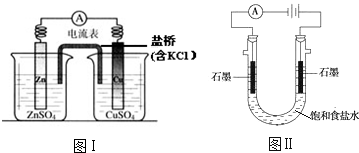

| A. | 图Ⅰ,电流形成的完整过程是:负极Zn-2e-═Zn2+,电子经导线流向正极,正极Cu2++2e-═Cu | |
| B. | 图Ⅰ,在不改变总反应的前提下,可用Na2SO4替换ZnSO4,用石墨替换Cu棒 | |
| C. | 图Ⅱ,通电后H+和Na+先从阳极区移动到阴极,然后阴极才发生反应2H++2e-═H2↑ | |
| D. | 图Ⅱ,通电后,由于OH-向阳极迁移,导致阳极附近pH升高 |
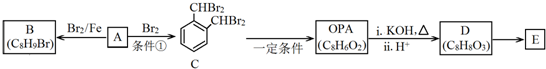
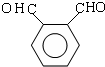 .
.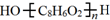 .D→E的化学方程式是n
.D→E的化学方程式是n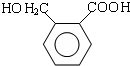 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$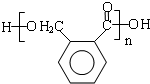 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).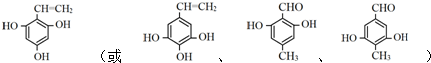 (写1种即可).
(写1种即可).