题目内容
下列描述违背化学原理的是( )
| A、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| B、反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C、SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
考点:反应热和焓变,化学平衡常数的含义,化学平衡的影响因素,电解原理
专题:
分析:A.相同质量的同种物质固态的能量比液态低;
B.温度不变,则平衡常数不变;
C.升高温度,可增大活化分子百分数;
D.阳极发生氧化反应生产氯气.
B.温度不变,则平衡常数不变;
C.升高温度,可增大活化分子百分数;
D.阳极发生氧化反应生产氯气.
解答:
解:A.相同质量的同种物质固态的能量比液态低,所以相同质量的水和冰相比较,水的能量高,故A正确;
B.温度不变,则平衡常数不变,故B错误;
C.升高温度,可增大活化分子百分数,可加快反应速率,故C正确;
D.阳极发生氧化反应生产氯气,电极方程式为2Cl--2e-=Cl2↑,故D正确.
故选B.
B.温度不变,则平衡常数不变,故B错误;
C.升高温度,可增大活化分子百分数,可加快反应速率,故C正确;
D.阳极发生氧化反应生产氯气,电极方程式为2Cl--2e-=Cl2↑,故D正确.
故选B.
点评:本题考查的知识主要涉及能量转化、电解等知识,为高频考点,侧重学生的分析能力以及基本理论知识的综合理解和运用的考查,难度不大,注意向知识的积累.

练习册系列答案
相关题目
常温下,将V1 mLc1mol/L的醋酸滴加到V2 mLc2mol/L的氢氧化钠溶液中,下列结论正确的是( )
| A、若c1?V1=c2?V2,则混合液中c(CH3COO-)=c(Na+) |
| B、若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
| C、若混合液的pH>7,且V1=V2,则一定有c1<c2 |
| D、若混合液的pH=7,则混合液中c1V1>c2V2 |
基态原子的核外电子排布为[Kr]4d55s2的元素属于的区、周期和族为( )
| A、p区、第五周期、ⅠB族 |
| B、d区、第五周期、ⅦB族 |
| C、d区、第四周期、ⅠB族 |
| D、ds区、第五周期、ⅠB族 |
如图是198K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
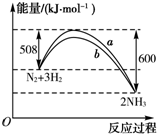

| A、该反应的热化学方程式为N2+3H2?2NH3△H=-92 kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,反应速率加快 |
下列说法正确的是( )
| A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、HCl和NaOH反应中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ?mol-1 |
关于离子键、共价键的各种叙述,下列说法中正确的是( )
| A、在离子化合物里,只存在离子键,没有共价键 |
| B、任何分子中一定都存在化学键 |
| C、在共价化合物分子内,一定不存在离子键 |
| D、全部由非金属元素形成的化合物中不可能含有离子键 |
等量金属钠进行下列实验,其中生成氢气最多的是( )
| A、将钠放入足量稀盐酸中 |
| B、将钠放入足量水中 |
| C、将钠放入硫酸铜溶液中 |
| D、将钠用铝箔包好并刺些小孔,再放入水中 |
下列物质中是非电解质的是( )
| A、硫酸钡 | B、烧碱 | C、水 | D、蔗糖 |
 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: