题目内容
关于离子键、共价键的各种叙述,下列说法中正确的是( )
| A、在离子化合物里,只存在离子键,没有共价键 |
| B、任何分子中一定都存在化学键 |
| C、在共价化合物分子内,一定不存在离子键 |
| D、全部由非金属元素形成的化合物中不可能含有离子键 |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:A.离子化合物中一定含有离子键,可能含有共价键;
B.单原子分子中不存在化学键;
C.只含共价键的化合物是共价化合物;
D.全部由非金属元素形成的化合物中可能含有离子键.
B.单原子分子中不存在化学键;
C.只含共价键的化合物是共价化合物;
D.全部由非金属元素形成的化合物中可能含有离子键.
解答:
解:A.离子化合物中一定含有离子键,可能含有共价键,如KOH,故A错误;
B.单原子分子中不存在化学键,如稀有气体,故B错误;
C.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故C正确;
D.全部由非金属元素形成的化合物中可能含有离子键,如铵盐,故D错误;
故选C.
B.单原子分子中不存在化学键,如稀有气体,故B错误;
C.只含共价键的化合物是共价化合物,共价化合物中一定不含离子键,故C正确;
D.全部由非金属元素形成的化合物中可能含有离子键,如铵盐,故D错误;
故选C.
点评:本题考查化学键和化合物的关系,明确物质的构成微粒及微粒之间的作用力即可解答,采用举例法分析解答,易错选项是B.

练习册系列答案
相关题目
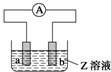 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
下列描述违背化学原理的是( )
| A、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| B、反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C、SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
下列属于吸热反应的是( )
| A、中和反应 |
| B、金属与酸反应置换出H2 |
| C、燃烧反应 |
| D、炽热的炭与水蒸气反应制取水煤气 |
45mL某气体,可能含有CO2、O2、NH3将其通过浓硫酸,气体体积无变化,通过足量的Na2O2后,体积变为30mL,则该气体的组成为( )
| A、CO2为30mL,O2为15mL |
| B、NH3为30mL,O2为15mL |
| C、CO2为15mL,O2为30mL |
| D、CO2 为30mL,O2为15mL |
下列化学反应对应的离子方程式正确的是( )
| A、KOH溶液与KHSO4溶液反应:OH-+H+═H2O |
| B、稀H2SO4与Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| C、铁与盐酸反应:Fe+2H+═Fe3++H2↑ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
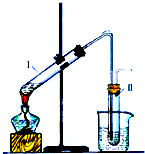 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题: 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: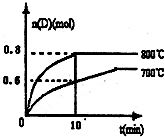 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1