题目内容
基态原子的核外电子排布为[Kr]4d55s2的元素属于的区、周期和族为( )
| A、p区、第五周期、ⅠB族 |
| B、d区、第五周期、ⅦB族 |
| C、d区、第四周期、ⅠB族 |
| D、ds区、第五周期、ⅠB族 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:基态原子的核外电子排布为[Kr]4d55s2,可知有5个电子层,最外层电子数为2,最后填充的电子为d电子,价电子排布为4d55s2,以此来解答.
解答:
解:基态原子的核外电子排布为[Kr]4d55s2,最后填充的电子为d电子,为d区元素;
可知有5个电子层,最外层电子数为2,价电子排布为4d55s2,位于第五周期、ⅦB族,
故选B.
可知有5个电子层,最外层电子数为2,价电子排布为4d55s2,位于第五周期、ⅦB族,
故选B.
点评:本题考查元素周期表的结构及应用,为高频考点,把握原子结构与元素位置的关系为解答的关键,侧重分析与应用能力的考查,注意最后填充电子及价电子,题目难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
已知氧化性Fe3+>Cu2+,向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、溶液中一定含有Fe2+ |
| B、溶液中一定含Cu2+ |
| C、剩余固体中一定含铜 |
| D、加入KSCN溶液一定不变红色 |
下列事实不能用电化学理论解释的是( )
| A、轮船水线以下的船壳上装一定数量的锌块 |
| B、铁可以在氯气中燃烧 |
| C、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| D、镀锌的铁比镀锡的铁耐用 |
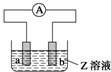 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
下列叙述中正确的是( )
| A、(CH3)2C═CHCH2CH3分子中的六个碳原子中至少有五个在同一个平面上 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
| D、间二溴苯仅有一种空间结构,这可以证明苯分子中不存在单双键交替的结构 |
下列描述违背化学原理的是( )
| A、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| B、反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C、SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
两个容积相同的容器中,一个盛有CO 气体,另一个盛有N2气.在同温同压下,两容器内的气体一定具有相同的:①分子数 ②原子数 ③质量 ④质子数 ⑤电子数( )
| A、只有①② | B、只有①②③ |
| C、只有①②④ | D、全部 |
 ,请写出设计合成实验时所涉及的有机反应类型:
,请写出设计合成实验时所涉及的有机反应类型: 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于相邻位置,它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: