题目内容
常温下,将V1 mLc1mol/L的醋酸滴加到V2 mLc2mol/L的氢氧化钠溶液中,下列结论正确的是( )
| A、若c1?V1=c2?V2,则混合液中c(CH3COO-)=c(Na+) |
| B、若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
| C、若混合液的pH>7,且V1=V2,则一定有c1<c2 |
| D、若混合液的pH=7,则混合液中c1V1>c2V2 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.当c1V1=c2V2时,反应生成醋酸钠,溶液显示碱性,此时溶液中的溶质为醋酸钠,根据醋酸钠溶液中的醋酸根离子水解分析;
B.混合液的pH=7,c(OH-)=c(H+),根据电荷守恒可知c(CH3COO-)=c(Na+);
C.醋酸是弱电解质,在其水溶液里存在电离平衡,当醋酸与氢氧化钠的物质的量相等时恰好生成醋酸钠,醋酸根离子水解,溶液显示碱性,而此时V1=V2、c1=c2;
D.如果混合液的pH=7,则醋酸应该稍过量.
B.混合液的pH=7,c(OH-)=c(H+),根据电荷守恒可知c(CH3COO-)=c(Na+);
C.醋酸是弱电解质,在其水溶液里存在电离平衡,当醋酸与氢氧化钠的物质的量相等时恰好生成醋酸钠,醋酸根离子水解,溶液显示碱性,而此时V1=V2、c1=c2;
D.如果混合液的pH=7,则醋酸应该稍过量.
解答:
解:A.当c1V1=c2V2时,反应后的溶质为醋酸钠,醋酸根离子的水解,溶液显示碱性,混合液中c(CH3COO-)<c(Na+)故A错误;
B.若混合溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知:c(CH3COO-)=c(Na+),故B错误;
C.V1=V2、c1=c2时,醋酸与氢氧化钠的物质的量相等,二者反应生成醋酸钠,由于醋酸根离子的水解,溶液显示碱性,溶液的pH>7,所以,若V1=V2,且溶液的pH>7,不一定满足c1<c2,故C错误;
D.若混合液的pH=7,则醋酸应该稍过量,c1v1>c2v2,故D正确;
故选D.
B.若混合溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知:c(CH3COO-)=c(Na+),故B错误;
C.V1=V2、c1=c2时,醋酸与氢氧化钠的物质的量相等,二者反应生成醋酸钠,由于醋酸根离子的水解,溶液显示碱性,溶液的pH>7,所以,若V1=V2,且溶液的pH>7,不一定满足c1<c2,故C错误;
D.若混合液的pH=7,则醋酸应该稍过量,c1v1>c2v2,故D正确;
故选D.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后的定性判断方法,明确弱电解质在溶液中存在电离平衡,能够根据电荷守恒、质子守恒等知识判断溶液中各离子浓度大小.

练习册系列答案
相关题目
实验室中电解饱和氯化钠溶液时,不能直接得到的物质是( )
| A、氯气 | B、氢气 |
| C、氢氧化钠 | D、氯化氢 |
已知氧化性Fe3+>Cu2+,向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
| A、溶液中一定含有Fe2+ |
| B、溶液中一定含Cu2+ |
| C、剩余固体中一定含铜 |
| D、加入KSCN溶液一定不变红色 |
下列描述违背化学原理的是( )
| A、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| B、反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C、SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |




 ,合成路线是
,合成路线是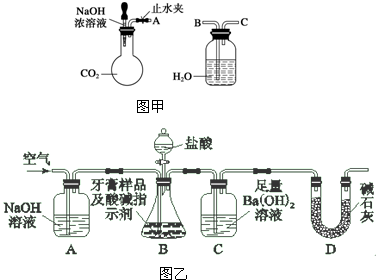
 ,请写出设计合成实验时所涉及的有机反应类型:
,请写出设计合成实验时所涉及的有机反应类型: ).
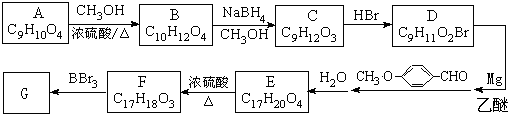
).
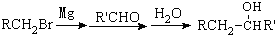
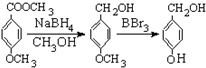
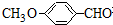 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: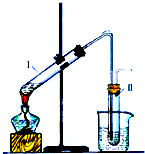 如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题:
如图是实验室制取溴乙烷的装置示意图,烧杯中装有自来水,试管I和试管II中均事先装有少量蒸馏水.请回答下列问题: