题目内容
如图是198K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
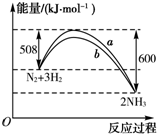

| A、该反应的热化学方程式为N2+3H2?2NH3△H=-92 kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,反应速率加快 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量-吸收的能量分析;
B、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
C、根据催化剂不改变化学平衡,催化剂与能耗的关系分析
D、根据影响反应速率的因素回答.
B、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
C、根据催化剂不改变化学平衡,催化剂与能耗的关系分析
D、根据影响反应速率的因素回答.
解答:
解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g) △H=-92kJ?mol-1,故A错误;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故C错误;
D、升高温度,增大了活化分子的百分数,所以反应速率加快,故D正确.
故选D.
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故C错误;
D、升高温度,增大了活化分子的百分数,所以反应速率加快,故D正确.
故选D.
点评:本题考查了化学反应中能量转化与催化剂的关系,热化学方程式的书写,图象的应用能力,难度不大,注意化学平衡的特征是可逆反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
保护地下钢管不受腐蚀,可使它连接( )
| A、铜板 | B、石墨 |
| C、直流电源负极 | D、直流电源正极 |
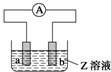 如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,
如图中a、b分别是原电池的两极,接通电路后发现a极板质量增加,b极板溶解,符合这一情况的是( )
| a极板 | b极板 | a电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 正极 | CuCl2 |
| A、A | B、B | C、C | D、D |
下列描述违背化学原理的是( )
| A、“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
| B、反应A(g)+3B(g)?2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C、SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
下列属于吸热反应的是( )
| A、中和反应 |
| B、金属与酸反应置换出H2 |
| C、燃烧反应 |
| D、炽热的炭与水蒸气反应制取水煤气 |
下列关于电解质溶液的叙述中正确的是( )
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类相同 | ||
| B、在CH3COONa溶液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
C、在0.1mol?L-1的醋酸溶液中加入适量的蒸馏水,溶液的
| ||
| D、常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸 |
 ).
).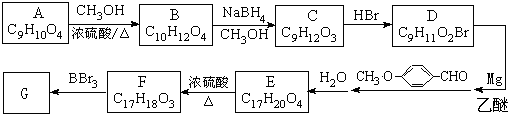
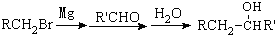
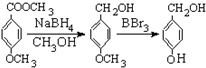
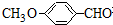 有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: ③CH3CH2CH3 ④HC
③CH3CH2CH3 ④HC CCH3⑤
CCH3⑤ ⑥CH3CH=CHCH3
⑥CH3CH=CHCH3 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1