题目内容
下列有关电化学装置的说法正确的是( )
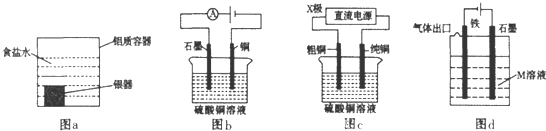

| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.形成原电池反应,Ag2S为正极被还原;
B.铜为阴极,发生还原反应;
C.电解精炼时,粗铜作阳极,纯铜作阴极;
D.铁作原电池正极时属于“牺牲阳极的阴极保护法”.
B.铜为阴极,发生还原反应;
C.电解精炼时,粗铜作阳极,纯铜作阴极;
D.铁作原电池正极时属于“牺牲阳极的阴极保护法”.
解答:
解:A.形成原电池反应,Al为负极,被氧化,Ag2S为正极被还原,正极方程式为Ag2S+2e-=2Ag+S2-,故A正确;
B.铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,故B错误;
C.图c中的X极若为负极,粗铜为阴极,不能进行粗铜的精炼,而电解精炼时,粗铜作阳极,纯铜作阴极,故C错误;
D.该装置有外接电源,属于“有外加电源的阴极保护法”,故D错误.
故选A.
B.铜为阴极,发生还原反应,不能溶解,石墨电极上生成氧气,故B错误;
C.图c中的X极若为负极,粗铜为阴极,不能进行粗铜的精炼,而电解精炼时,粗铜作阳极,纯铜作阴极,故C错误;
D.该装置有外接电源,属于“有外加电源的阴极保护法”,故D错误.
故选A.
点评:本题考查较为综合,涉及原电池和电解池原理,为高频考点,注意根据金属的腐蚀及保护、粗铜的精炼、电解原理等知识来分析解答,难度不大.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
铜在一定条件也会生锈,其主要成分是铜绿,化学式为Cu2(OH)nCO3,式中n等于( )
| A、1 | B、2 | C、3 | D、4 |
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、78g苯含有碳碳双键的数目为3NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、1mol Fe与足量稀HNO3反应,转移3NA个电子 |
| D、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中已铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )| A、阳极电极方程式为Al-3e+6OH-=Al2O3+H2O |
| B、随着电解的进行,溶液的PH逐渐增大 |
| C、当阴极生成气体3.36L(标况)时,阳极增重2.4g |
| D、电解过程中H+移向Al电极 |
常见的无机酸25℃时在水溶液中的电离平衡常数,下列选项正确的是( )
| 无机酸 | 氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
| 电离平衡常数K值 | 6.2×10-10(K) | 4.2×10-7(K1) 5.6×10-11(K2) |
6.61×10-4(K) |
| A、氟化钠溶液中通入过量CO2 F-+H2O+CO2=HF+HCO3- |
| B、Na2CO3溶液中2C(Na+)=C(CO32-)+C(HCO3-)+C(H2CO3) |
| C、中和等体积、等pH的氢氰酸(HCN)和氢氟酸(HF)消耗NaOH的量前者大于后者 |
| D、等浓度的NaCN和NaF溶液中PH值前者小于后者 |
下列离子方程式书写正确的是( )
| A、向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | ||||
B、向铜作电极电解硫酸溶液:2H2O
| ||||
| C、向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | ||||
| D、向AlCl3溶液中加入过量的Na:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ |
A、B、C是原子序数依次增大的短周期元素,A元素某种同位素原子在考古方面有重要应用,B的最外层电子是电子层数的三倍,C的焰色反应呈黄色,下列说法正确的是( )
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
