题目内容
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1:

(1)Cu元素基态原子的外围电子排布式为 .
(2)1mol氨基乙酸钠中含有σ键的数目为 .
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式).已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 .
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2,则该化合物的化学式是 .

(1)Cu元素基态原子的外围电子排布式为
(2)1mol氨基乙酸钠中含有σ键的数目为
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体
(4)硫酸根离子的空间构型为
考点:配合物的成键情况,原子核外电子排布,晶胞的计算
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理书写其基态原子外围电子排布式;
(2)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键;
(3)原子个数相等、价电子数相等的微粒为等电子体,非极性分子的溶质极易溶于非极性分子的溶剂;
(4)根据价层电子对互斥理论确定硫酸根离子的空间构型;利用均摊法确定该化合物的化学式.
(2)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键;
(3)原子个数相等、价电子数相等的微粒为等电子体,非极性分子的溶质极易溶于非极性分子的溶剂;
(4)根据价层电子对互斥理论确定硫酸根离子的空间构型;利用均摊法确定该化合物的化学式.
解答:
解:(1)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为3d104s1,故答案为:3d104s1;
(2)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键,所以1mol氨基乙酸钠中含有σ键的数目为8NA,故答案为:8NA;
(3)原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为:N2O(或SCN-、N3-等),
根据相似相溶原理知,非极性分子的溶质极易溶于非极性分子的溶剂,CO2和CS2都是非极性分子,水是极性分子,所以CO2极易溶于CS2中,
故答案为:N2O(或SCN-、N3-等);CO2与CS2均是非极性分子,而水是极性分子,依据相似相容原理,所以CO2在水中溶解度不大,却易溶于CS2;
(4)SO42-价层电子对个数=4+
(6+2-4×2)=4且不含孤电子对,所以其空间构型为正四面体;利用均摊法知,该化合物中O原子个数=1+8×
=2,Cu原子个数=4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为:Cu2O,故答案为:正四面体型;Cu2O.
(2)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键,所以1mol氨基乙酸钠中含有σ键的数目为8NA,故答案为:8NA;
(3)原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为:N2O(或SCN-、N3-等),
根据相似相溶原理知,非极性分子的溶质极易溶于非极性分子的溶剂,CO2和CS2都是非极性分子,水是极性分子,所以CO2极易溶于CS2中,
故答案为:N2O(或SCN-、N3-等);CO2与CS2均是非极性分子,而水是极性分子,依据相似相容原理,所以CO2在水中溶解度不大,却易溶于CS2;
(4)SO42-价层电子对个数=4+
| 1 |
| 2 |
| 1 |
| 8 |
点评:本题涉及的知识点有晶胞的计算、等电子体、价层电子对互斥理论等知识点,利用均摊法、等电子体概念、价层电子对互斥理论来分析解答即可,题目难度中等;高考题中对于物质结构和性质的考查时,不是单纯的涉及一个考点,常常将各个考点融入到一个大型题中,考查知识较全面,要求学生对各个考点熟练掌握,一般来说,有关晶胞的计算较难.

练习册系列答案
相关题目
下列各组物质中,互为同分异构体的是( )
| A、冰和水 |
| B、氧气和臭氧 |
| C、1H与3H |
| D、CH3CH20H和CH30CH3 |
下列有关电化学装置的说法正确的是( )
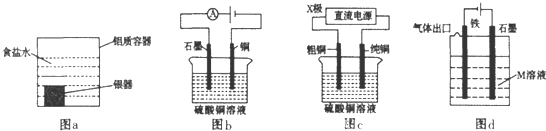

| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银分别放入下列溶液中,相同温度下c(Ag+)最大的是( )
| A、100mL蒸馏水 |
| B、100mL 0.2mol?L-1 AgNO3 |
| C、100 mL 0.1mol?L-1 AlCl3 |
| D、100mL 0.1 mol?L-1盐酸 |
下列说法正确的是( )
| A、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
| B、用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在有机溶剂中的溶解能力较Cu2+小 |
| C、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
| D、银氨溶液不能留存,久置后会变成氮化银,容易爆炸 |
 仔细观察下面两种电池的构造示意图,完成下列问题:
仔细观察下面两种电池的构造示意图,完成下列问题:
