题目内容
用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A、78g苯含有碳碳双键的数目为3NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、1mol Fe与足量稀HNO3反应,转移3NA个电子 |
| D、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、苯分子结构中不含有碳碳双键;
B、常温常压下,22.4L二氧化碳气体物质的量不是1mol;
C、铁和足量硝酸反应生成硝酸铁,依据电子守恒计算;
D、次氯酸根离子是弱酸阴离子水溶液中水解;
B、常温常压下,22.4L二氧化碳气体物质的量不是1mol;
C、铁和足量硝酸反应生成硝酸铁,依据电子守恒计算;
D、次氯酸根离子是弱酸阴离子水溶液中水解;
解答:
解:A、苯分子结构中不含有碳碳双键,是完全等同的碳碳键,故A错误;
B、已经气体摩尔体积的条件应用分析,常温常压下,22.4L二氧化碳气体物质的量不是1mol,故B错误;
C、铁和足量硝酸反应生成硝酸铁,依据电子守恒计算,1mol Fe与足量稀HNO3反应,转移3NA个电子,故C正确;
D、次氯酸根离子是弱酸阴离子水溶液中水解,1L 1mol?L-1的NaClO溶液中含有ClO-的数目小于NA,故D错误;
故选C.
B、已经气体摩尔体积的条件应用分析,常温常压下,22.4L二氧化碳气体物质的量不是1mol,故B错误;
C、铁和足量硝酸反应生成硝酸铁,依据电子守恒计算,1mol Fe与足量稀HNO3反应,转移3NA个电子,故C正确;
D、次氯酸根离子是弱酸阴离子水溶液中水解,1L 1mol?L-1的NaClO溶液中含有ClO-的数目小于NA,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件分析,物质结构的理解应用,盐类水解和氧化还原反应电子转移的分析判断方法,题目难度中等.

练习册系列答案
相关题目
下列各组物质中,互为同分异构体的是( )
| A、冰和水 |
| B、氧气和臭氧 |
| C、1H与3H |
| D、CH3CH20H和CH30CH3 |
X、Y、Z、W是前20号元素,原子序数依次增大.X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫.下列说法错误的是( )
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: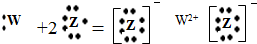 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
下列有关离子(或物质)的检验及结论正确的是( )
| A、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B、向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C、向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D、向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
下面各装置图能达到实验目的是( )
A、 实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中 |
B、 实验Ⅱ用CaC2和饱和食盐水反应制取C2H2 |
C、 实验Ⅲ制取氨气 |
D、 实验Ⅳ褪色证明了乙烯可以与溴发生加成反应 |
下列有关电化学装置的说法正确的是( )
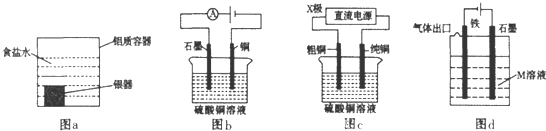

| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银分别放入下列溶液中,相同温度下c(Ag+)最大的是( )
| A、100mL蒸馏水 |
| B、100mL 0.2mol?L-1 AgNO3 |
| C、100 mL 0.1mol?L-1 AlCl3 |
| D、100mL 0.1 mol?L-1盐酸 |